
Apesar dos conhecimentos científicos sobre as enzimas já contarem com quase um século de existência, somente a partir de 1954 Karmem demonstrou a associação entre a ocorrência de uma doença aguda, o infarto do miocárdio e a elevação plasmática de uma determinada enzima, a transaminase.
Naquela época apenas meia dúzia de enzimas era utilizada em clinica medica, sendo que nenhuma delas estava envolvida com o metabolismo intracelular. Todas se relacionavam com fenômenos digestivos ou hidrolíticos extracelulares. A lípase e a amilase, por exemplo, já eram ligadas, desde 1930, aos casos de pancreatites agudas quando apresentavam atividades plasmáticas elevadas. Nesta mesma década, Bodansky, Gutman, King e outros investigadores estudaram as fosfatases no soro e demonstraram que a alcalina elevava sua atividade sérica em varias doenças hepáticas e ósseas e a acida, no carcinoma prostático.Enquanto quatro ou cinco enzimas eram dosadas no passado, hoje em torno de uma trintena é rotineiramente dosada e quase uma centena delas encontra-se disponível para ser utilizada no diagnostico clínico de diversas situações nosológicas.
A enzimologia clínica é uma das especialidades da química clínica que mais têm se desenvolvido ultimamente, sobretudo, devido aos progressos teóricos da bioquímica e do enorme desenvolvimento das técnicas laboratoriais. No entanto, este rápido crescimento levou a um estágio atual de reflexão entre os especialistas, não por causa da utilidade que a enzimologia clínica desempenha como coadjuvante importante ao prognostico e acompanhamento da evolução de inúmeras doenças, mas por falta de otimização, padronização e controle de qualidade das variadas técnicas usadas para a determinação das atividades enzimáticas. A otimização de uma técnica de medida enzimática deve permitir a expressão de sua atividade máxima sob uma temperatura determinada e deve estar suficientemente adaptada para fornecer resultados livres de interferências, já a padronização trata da escolha de uma única modalidade metodológica para a determinação da atividade enzimática, assim como da expressão dos resultados achados. Ela deve especificar não somente a temperatura, na qual a velocidade da reação deve ser medida, como a natureza, o pH, a concentração do tampão, a concentração do substrato, cofatores e efetores, etc. O controle de qualidade mede a eficácia das determinações enzimáticas assim como as variações interlaboratoriais.
As diversas técnicas usadas para avaliações das atividades enzimáticas dependem muito das condições do laboratório e do tipo de uso clínico.
Conteúdo
Introdução
Atividade Enzimática:
1. Determinação da Atividade Enzimática
2. Metodologias empregadas para a determinação das atividades
enzimáticas
Principais Causas de Erro nas Determinações Enzimáticas:
1. Erros na coleta da amostra
2. Erros na conservação da amostra
3. Tabela 1: Perda média da atividade enzimática durante a conservação
do soro
4. Erros nas determinações da atividade enzimática
5. Erros na avaliação dos resultados7
Tabela 2: Principais Enzimas de Interesse Clínico
Enzimas nas Doenças Pancreáticas
1. Amilase
2. Lipase
Enzimas nas Doenças Hepáticas:
1. Alanina Aminotransferase (ALT)
2. Aspartato Aminotransferase (AST)
3. Fosfatase Alcalina (ALP)
4. Gama Glutamiltransferase (Gama GT)
5. Colinesterase (CHE)
Enzimas nas Doenças Cardíacas:
1. Creatino Quinase (CK)
2. Desidrogenase Láctica (LDH)
3. Aspartato Aminotransferase (AST)
Marcadores Bioquímicos do Infarto do Miocárdio:
1. Marcadores Clássicos
2. Novos Marcadores
Enzimas em Doenças da Próstata:
1. Fosfatase Ácida
2. Antígeno Prostático Específico (PSA)
Bibliografia
Esse material tem a finalidade apenas ser ser um breve “resumo” de algumas enzimas comumente usadas no Laboratório Clínico. Vale ressaltar que enzimas são métodos dependentes para os valores de referência. Outras enzimas também podem não estar descritas aqui.
INTRODUÇÃO
As enzimas são catalisadores protéicos responsáveis pela maioria das reações químicas do organismo, sendo encontradas em todos os tecidos. De uma maneira geral, a concentração de enzimas no soro é baixa, podendo aumentar significativamente após uma lesão celular orgânica. Na maioria dos estados patológicos em que ocorre elevação da concentração de enzimas, a causa é o aumento da permeabilidade da membrana por uma lesão ou necrose celular com as enzimas difundindo-se para os capilares e atingindo a corrente circulatória. Ocasionalmente, os níveis aumentados de enzimas no soro são provocados por aumento na síntese enzimática intracelular com conseqüente difusão dessas enzimas para a circulação sanguínea.
A determinação de enzimas no Laboratório Clínico tem uma grande aplicação para o diagnóstico, prognóstico e acompanhamento da terapia de diversas patologias, especialmente o caso das doenças hepáticas, cardíacas, ósseas, musculares e pancreáticas. Em alguns processos patológicos, as determinações enzimáticas contribuem significativamente para estabelecer a causa, localização e grau de extensão da lesão, para fazer o controle do tratamento e ainda para determinar a cura. Assim sendo, as dosagens enzimáticas são extremamente importantes para a compreensão e controle de inúmeras doenças. Na atualidade, cerca de 10 enzimas são dosadas nos laboratórios clínicos, compreendendo, aproximadamente, 20 a 25% do total de exames realizados. Os objetivos deste manual são:
- estudar a atividade enzimática, sua determinação e unidades empregadas.
- descrever as principais causas de erro nas determinações enzimáticas.
- descrever as características das principais enzimas dosadas no laboratório clínico e suas aplicações no diagnóstico de patologias.
- apresentar os métodos de dosagem mais empregados para essas enzimas e os respectivos valores de referência.
ATIVIDADE ENZIMÁTICA
Neste manual não iremos aprofundar no estudo das propriedades, modo de ação e cinética enzimática, que podem ser mais bem estudadas nos livros de bioquímica e em textos específicos sobre enzimologia.
Quando uma enzima age sobre um substrato, a primeira fase compreende a formação do complexo enzima-substrato (ES). A enzima liga-se ao substrato em um local específico, através do seu sítio ativo. Durante algum tempo, a enzima age sobre o substrato formando o produto e sendo liberada intacta para poder unir-se a outra molécula de substrato. A ação enzimática pode ser assim esquematizada:
A velocidade de uma reação enzimática depende de uma variedade de fatores como: concentração da enzima, concentração do substrato, temperatura da reação, pH do meio, força iônica e presença de ativadores e inibidores. Há enzimas que necessitam da ação de uma coenzima (cofator) para poderem atuar sobre o substrato. Geralmente, as coenzimas são moléculas pequenas, não protéicas, termo-estáveis, derivados principalmente de vitaminas B1 e B6, dos nucleotídeos NADH e NADPH, etc. As reações enzimáticas requerendo NADH e NADPH como coenzimas são bastante empregadas em análises clínicas.
Determinação da Atividade Enzimática
De uma maneira geral, as enzimas são medidas através de suas atividades catalíticas e os resultados de tais determinações são expressos em termos da quantidade de atividade presente em determinado volume ou massa da amostra. A unidade de atividade é a medida da velocidade em que a reação se realiza, por exemplo, a quantidade de substrato consumido ou a quantidade de produto formado em uma unidade de tempo.
De acordo com a Comissão de Enzimas (EC) da União Internacional de Bioquímica (IUB), uma unidade de uma enzima - Unidade Internacional (U) - é a quantidade de enzima que catalisa a transformação de 1 micromol de substrato por minuto, nas condições padrão por ela recomendadas. Portanto, a atividade catalítica não se refere à quantidade ou ao peso da enzima, porque ainda não é possível purificar a grande maioria das enzimas. A atividade específica é entendida como sendo a atividade por unidade de peso da proteína.
Nos líquidos biológicos, as atividades catalíticas são, em geral, referidas para 1mL ou para 1
litro. Por essa razão são expressas em mU/mL ou U/L, que numericamente são iguais (mU/mL = U/L). Atualmente, deve-se usar a designação internacional, ou seja, U/L ou simplesmente U.
1 Unidade Internacional (U) = 1 micromol/minuto/litro = µmol/min/L
Mais recentemente, a União Internacional de Bioquímica (IUB) e a União Internacional de Química Pura e Aplicada (IUPAC) têm recomendado que a atividade catalítica deva ser expressa em mol/s, dando à nova unidade o nome de Katal. Assim a dosagem enzimática deveria ser expressa em katal por litro (kat/L). A justificativa é baseada no Sistema Internacional (SI) de Medidas que preconiza o mol como unidade do substrato transformado e o segundo como unidade de tempo. Entretanto, essa recomendação não tem sido adotada universalmente.
1 kat = 1 mol/segundo/litro = 1 mol/s/L
Na prática, utiliza-se o microkat (µkat = 10-6 kat) ou o nanokat (nkat = 10-9 kat)
Transformação de Unidade Internacional (U) em Unidade Catalítica (Kat)
1 U = 1 µmol/min/L e 1 Kat = 1 mol/s/L à1 µmol = 10-6 mol e 1 min = 60 s
Assim: 1 U = 10-6 mol/60s = 0,01667 x 10-6 mol/s = 16,67 x 10-9 mol/s = 16,67 nmol/s
= 16,67 nKat
1 U = 16,67 nKat 1 nKat = 0,06 U
Anteriormente, quando se desenvolvia uma metodologia para as dosagens enzimáticas, as unidades eram definidas de acordo com o idealizador do método baseado nas condições experimentais, sem obedecer a um critério pré-estabelecido. Essas unidades estão em desuso hoje e devem ser transformadas, quando possível, em Unidade Internacional (U) ou em Unidade Catalítica (Kat).
Metodologias empregadas para a determinação das atividades enzimáticas
1-Métodos que analisam o consumo do substrato
Incluem os métodos que determinam a quantidade de substrato não consumido através de uma reação adequada. Como exemplo dessa metodologia temos a dosagem da amilase pelo Método de Caraway em que o substrato de amido empregado no sistema é hidrolisado pela amilase, havendo formação de glicose, maltose, dextrinas. A porção do amido não hidrolisado na reação será complexado pela adição da solução de iodo, originando uma coloração azul, que é analisada fotometricamente em comparação com um controle de substrato.
2-Métodos que analisam o produto formado
Incluem os métodos que determinam a quantidade de produto formado através de uma reação apropriada. Como exemplos dessa metodologia, dois tipos de sistema são utilizados no laboratório clínico:
Métodos em que o produto formado na reação já é um composto corado
Dosagem da fosfatase alcalina pelo método do paranitrofenol em que o substrato de p- nitrofenilfosfato é hidrolisado pela fosfatase alcalina, liberando p-nitrofenol (amarelo), que é analisado fotometricamente através da medida da velocidade da reação ( ∆A/min).
Outros exemplos desse tipo de sistema são as dosagens da gamaglutamil transferase (GGT) pelo método de Szass, da amilase pelo método do cloronitrofenol, etc.
Métodos em que o produto formado tem que ser transformado em composto corado
Dosagem da fosfatase alcalina pelo método de Roy em que o substrato de timolftaleína monofosfato é hidrolisado pela enzima, liberando a timolftaleína que após a adição de um tampão alcalino, adquire coloração azul. O composto azul formado é comparado fotometricamente com um padrão de timolftaleína.
Outros exemplos desse tipo de sistema são as dosagens da fosfatase ácida pelo método de Roy, das transaminases pelo método de Reitman-Frankel, etc.
3- Métodos que analisam a variação de absorção do coenzima que participa da reação enzimática
São metodologias baseadas no princípio de que as formas reduzidas dos coenzimas NADH e NADPH absorvem energia na faixa ultravioleta do espectro eletromagnético radiante, enquanto que as formas oxidadas NAD+ e NADP+ não apresentam essa absorção. Deste modo, o sistema de dosagem acompanha a transformação da forma oxidada para a reduzida ou vice-versa da coenzima participante da reação. Como a reação química envolvida é estequiométrica, para cada mol de substrato consumido um mol de coenzima será oxidado ou reduzido. Assim, a diminuição ou o aumento da absorbância medido por minuto (∆A/min) é diretamente proporcional à atividade da enzima. Muitos são os sistemas de dosagens enzimáticas que empregam esse princípio e dentre eles temos as dosagens da LDH-UV, CKUV, AST-UV, ALT-UV, etc.
Ex: Dosagem da desidrogenase láctica (LDH) pelo método do ultravioleta:
O substrato de ácido láctico é transformado (oxidado) em ácido pirúvico, enquanto que a coenzima NAD+ é reduzido para NADH. O sistema mede o aumento da absorção no ultravioleta (∆A/min) quando o NAD+ se transforma em NADH.
A dosagem da LDH pode também ser realizada empregando como substrato o ácido pirúvico em que o sistema mede a diminuição da absorção no ultravioleta (∆A/min) quando o NADH se transforma em NAD+. O ácido pirúvico é transformado (reduzido) em ácido láctico, enquanto a coenzima NADH é oxidada para NAD+.
4-Métodos Otimizados: são métodos propostos pela Associação Alemã para a Química Clínica com o objetivo de se obter resultados comparáveis nas determinações enzimáticas. Apresentam uma sensibilidade elevada e excelente reprodutibilidade. As condições da reação como temperatura, tipo e concentração do tampão, pH das soluções, concentração do substrato, concentração do coenzima, presença de cofatores e efetores são todas padronizadas.
5-Outros métodos que podem ser utilizados nas dosagens enzimáticas
Diversas metodologias baseadas em imunoensaios como radioimunoensaio, enzimaimunoensaio, fluorescência, luminescência, quimioluminescência, eletroforese, contraimunoeletroforese e eletrofocalização podem também ser aplicados na determinação das enzimas e isoenzimas.
PRINCIPAIS CAUSAS DE ERRO NAS DETERMINAÇÕES ENZIMÁTICAS
A partir da coleta da amostra biológica até a liberação do resultado final de uma dosagem enzimática, vários erros podem ser inseridos. Em vista disso, é muito importante o conhecimento das causas de erro e das maneiras de evitá-los a fim de assegurar a qualidade do resultado.
Os principais erros nas dosagens enzimáticas são:
Erros na coleta da amostra
Para a obtenção de resultado confiável em uma determinação de qualquer enzima, é necessário que a coleta, manuseio, armazenamento e transporte da amostra biológica sejam feitos de acordo com as recomendações específicas para cada dosagem, uma vez que são vários os fatores que podem alterar as atividades enzimáticas:
1. Uso de Anticoagulantes
O soro é o material de escolha para as dosagens enzimáticas no sangue.
O uso de anticoagulantes pode provocar erros de inibição. Exs:
· oxalato, citrato e EDTA inibem a amilase;
· o oxalato inibe as transaminases;
· citrato e oxalato inibem a GT;
· a heparina inibe a LDH.
2. Hemólise
Não se deve utilizar uma amostra hemolisada para as dosagens enzimáticas porque a lise das hemácias contaminará o soro ou plasma com elementos intracelulares que poderão causar alteração nas atividades enzimáticas. Exs:
· liberação de fosfatase ácida e LDH que existem em altas concentrações nas hemácias;
· inibição da lipase pela hemoglobina.
3. Estase Venosa
Uma estase venosa demorada (garroteamento demorado e/ou muito apertado) provoca hipóxia, falta de oxigênio, aumentando a permeabilidade das membranas celulares com liberação do conteúdo celular para o soro ou plasma. Ex: liberação de transaminases, LDH, fosfatase ácida.
4. Coagulação
A separação do soro ou plasma deve ser feita o mais rápido possível porque a coagulação provoca desintegração de hemácias e plaquetas, podendo contaminar a amostra com suas enzimas.
5. Lipemia
Soro ou plasma muito turvos (lipemia intensa) podem provocar turbidez na reação enzimática, e consequentemente, um erro fotométrico.
Erros na conservação da amostra
As dosagens enzimáticas devem ser realizadas o mais breve possível para evitar perdas da atividade. Quando for necessário uma conservação, ela deve ser feita por um período de tempo curto, e geralmente, a 4°C. A TABELA 1 mostra a perda média da atividade de algumas enzimas quando o soro é conservado a 4 e a 25°C. O congelamento da amostra deve ser evitado porque a cristalização da água do soro causa uma alteração irreversível das ligações de hidrogênio das enzimas, e consequentemente, a sua desnaturação.
Enquanto algumas enzimas como a fosfatase alcalina e a γGT são relativamente estáveis no soro, outras como a fosfatase ácida perdem a atividade em poucas horas, devido à alcalinização do soro pela perda de CO2 . Em vista disto, o soro para a dosagem da fosfatase ácida deve ser acidificado logo após a coleta, adicionando-se a cada mL de soro 0,02 mL (20 µL) de tampão acetato 5 M pH 5,0 ou 0,01 mL (10 µL) de ácido acético 20% v/v.
O envelhecimento do soro causa também proteólise com perda de estruturas terciárias e bloqueamento dos grupos -SH das enzimas, com conseqüente perda da atividade.
TABELA 1
PERDA MÉDIA DA ATIVIDADE ENZIMÁTICA DURANTE A CONSERVAÇÃO DO SORO
* Somente com reativação por N-acetil-cisteína (NAC)
** Somente em soro acidificado (pH = 5,5-6,0)
Referência: Schmidt, E. e Schmidt, F.W.: Kleine Enzym-Fibel, Boehringer Mannheim GmbH, 1966 e 1976.
Erros nas determinações da atividade enzimática
Em toda determinação enzimática é muito importante ter conhecimento dos fatores que afetam a velocidade da reação, a saber:
1. Tempo de reação estipulado pela metodologia: o tempo ótimo da reação é característico para cada ensaio e deve ser rigorosamente obedecido pelo analista.
2. pH ótimo da reação: cada enzima apresenta um pH ótimo para a sua ação catalítica, o qual facilita a interação química entre a enzima e o substrato para a formação do complexo E-S. As reações enzimáticas têm que ser realizadas sob rigoroso controle do pH estabelecido pela metodologia
3. Temperatura da reação: a formação do complexo E-S exige uma quantidade de energia em forma de calor para se completar. A temperatura ótima para a maioria das enzimas oscila em torno de 37°C. O analista deve obedecer a temperatura estipulada na metodologia.
4. Concentração do substrato: nas reações enzimáticas, a velocidade da reação aumenta com o aumento da concentração de substrato, até um certo ponto em que toda a enzima presente encontra-se combinada com o substrato, na forma do complexo E-S. Neste ponto, temos a velocidade máxima da reação (Vmax) e a quantidade de substrato presente não influi mais sobre ela. Em enzimologia deve-se trabalhar nessas condições, isto é, em reações de ordem zero.
5. Concentração da enzima: dentro de certos limites, a velocidade da reação enzimática é proporcional à concentração da enzima. Estando a enzima em altas concentrações há perda da linearidade do método e a reação enzimática irá se processar fora das condições ideais. Quando a enzima encontra-se em alta concentração (ex. ALT na hepatite virótica aguda) haverá uma transformação rápida do substrato, em tempo inferior ao estabelecido pela metodologia. Nesta situação, o substrato será totalmente consumido e ainda ficará enzima sem se complexar por falta de substrato. Este fato deve ser observado pelo analista através da linearidade indicada para o método. Se, após a reação enzimática, for notada uma ultrapassagem da linearidade metodológica deve-se fazer nova dosagem utilizando o material biológico diluído para que seja mantida a condição de reação de ordem zero.
6. Estabilidade dos reagentes: nunca trabalhar com reagentes apresentando vencimento de validade e sempre obedecer aos cuidados para a conservação dos mesmos
7. Pipetagem: o analista deve ser bastante rigoroso com a pipetagem dos reagentes e amostras biológicas.
8. Limpeza da vidraria: na análise, sempre trabalhar com material rigorosamente limpo.
Erros na avaliação dos resultados
Como a meta de todo Laboratório Clínico é fornecer resultados corretos e confiáveis, nas determinações enzimáticas é necessário também fazer o controle da qualidade das análises. Para assegurar a precisão e exatidão nas dosagens enzimáticas é necessário que o analista tenha conhecimento da cinética, dos fatores interferentes e das causas de erro.
Um programa de controle da qualidade das dosagens enzimáticas deve incluir:
1. Ensaios com reação de cinética de ordem zero.
2. Estudos de proporcionalidade com aumento do volume de amostra.
3. Uso de soro controle de referência dos programas nacionais de controle de qualidade ou adquirido no comércio ou ainda pool de soro preparado no próprio laboratório.
4. Dosagens em replicatas para avaliar a precisão dos ensaios.
PRINCIPAIS ENZIMAS DE INTERESSE CLÍNICO
As principais enzimas determinadas no Laboratório Clínico com finalidades diagnósticas são apresentadas na TABELA 2, incluindo nomes e siglas comumente utilizadas, número de código da Comissão de Enzimas (EC) e objetivos diagnósticos.
TABELA 2
IUB = UNIÃO INTERNACIONAL DE BIOQUÍMICA
EC = COMISSÃO DE ENZIMAS
ENZIMAS NAS DOENÇAS PANCREÁTICAS
1. AMILASE
Sigla utilizada: AMS
Nome sistemático (IUB): α-1,4-Glucan-glucano hidrolase
Nome comum: Amilase
pH ótimo: 7,0 0,1
A amilase é uma enzima hidrolase normalmente secretada pelas células acinares do pâncreas para o ducto pancreático e deste para o duodeno. No intestino, a amilase hidrolisa os carbohidratos em seus componentes, os açúcares. Havendo uma lesão das células acinares como na pancreatite, ou ocorrendo uma obstrução no fluxo do ducto pancreático como no carcinoma pancreático, a amilase fluirá para o sistema linfático intrapancreático e peritoneo e, por drenagem, atingirá os vasos sanguíneos em concentração elevada. A amilase alcançará um aumento anormal dentro de 12 a 24 horas após o início da doença, sendo rapidamente clareada pelos rins, atingindo os níveis normais em 48 a 72 horas.
Nos casos de pancreatite persistente, obstrução dos ductos pancreáticos e pseudocisto pancreático, os níveis de amilase no soro estarão persistentemente aumentados.
Muito embora a amilase seja um teste sensível para diagnóstico de doenças pancreáticas, ela não é específica. Outras doenças não pancreáticas podem elevar os níveis de amilase no soro como na perfuração do intestino, na úlcera péptica penetrante para o pâncreas, na obstrução duodenal e nas parotidites (caxumba) devido à amilase salivar.
A cetoacidose diabética e a gravidez ectópica são também associadas com níveis altos de amilase no soro.
Nos casos de doenças crônicas do pâncreas como na pancreatite crônica, geralmente os níveis de amilase não são altos devido à destruição das células acinares responsáveis pela produção da enzima.
Como os rins clareiam rapidamente a amilase sanguínea, as doenças pancreáticas provocarão um conseqüente aumento da amilase urinária. Enquanto os níveis de amilase sérica regridem rapidamente para os valores de referência (1 a 2 dias), os níveis de amilase na urina permanecem elevados por mais tempo (5 a 7 dias) após o início dos sintomas. Este dado é muito importante para o diagnóstico de pancreatite em pacientes cujos sintomas permanecem por 3 dias ou mais.
A determinação da amilase na urina, assim como a dosagem no soro, também não é específica para as doenças pancreáticas. Outras doenças, tais como parotidite (caxumba), colecistite, perfuração de intestino, úlcera péptica penetrante, gravidez ectópica e infarto renal podem apresentar amilase urinária elevada. Contudo, nas pancreatites a taxa de amilase na urina estará sempre elevada. Entretanto, para um diagnóstico mais seguro de pancreatite é importante, juntamente com a dosagem da amilase sérica e urinária, determinar a Relação entre o Clareamento da Amilase e o Clareamento da Creatinina. Quando a Relação Clareamento Amilase/Clareamento Creatinina é igual a 5% ou mais, o diagnóstico de pancreatite pode ser feito com segurança. Quando a Relação é menor do que 5% em um paciente apresentando níveis elevados de amilase no soro e na urina, indica uma condição patológica não pancreática (macroamilasemia, perfuração de intestino, etc).
Relação Clareamento de Amilase /Clareamento de Creatinina
Determinar a atividade da amilase e a concentração da creatinina nas amostras de soro e urina, e aplicar os resultados na seguinte fórmula:
Valores elevados
As patologias que mais comumente apresentam valores altos de amilase são: pancreatite aguda primária, pancreatite crônica recidivante, úlcera péptica perfurada, perfuração de intestino, parotidite (caxumba), cetoacidose diabética, obstrução duodenal, colecistite aguda, gravidez ectópica e insuficiência renal.
Amostra biológica
Sangue. Usar soro ou plasma colhido com heparina. Não usar plasma colhido com citrato, EDTA ou oxalato porque produzem resultados falsamente elevados.
A atividade enzimática é estável 7 dias entre 15-25°C e 2 meses entre 2-8°C.
Não usar amostras com sinais de contaminação bacteriana.
Urina. A amostra a ser utilizada na dosagem pode ser uma urina colhida no intervalo de 2 horas, ou de 24 horas, ou então, de acordo com a solicitação médica. Quando se determina a amilase na amostra de uma micção, deve-se também determinar a creatinina na mesma amostra. O resultado deverá ser reportado como Relação Amilase/Creatinina (U/g), com o objetivo de compensar as variações da atividade da amilase em amostras obtidas em cada micção. As amostras de urina devem ser armazenadas entre 2-8 C. Não adicionar preservativo.
A dosagem de amilase pode também ser feita em amostras de líquidos ascítico, duodenal ou
pleural.
Relação Amilase/Creatinina na Amostra de Urina
Fatores interferentes
Drogas que podem provocar um aumento na amilase sérica e urinária são: ácido aminosalicílico, analgésicos narcóticos, anticoncepcionais orais, aspirina, azatioprina, corticosteroides, etanol, furosemida, glicocorticoides, metildopa, meios de contraste contendo iodo, e predinisona.
Drogas que podem diminuir os níveis de amilase no soro e na urina são: citratos, glicose e oxalatos.
Métodos de Dosagem
1. Metodologia Amiloclástica Cinética de Tempo Fixo (Método de Caraway mod.)
Fundamento Químico
A amilase hidrolisa o amido liberando moléculas de açúcares e dextrina, e com a adição de iodo ocorre a formação de cor azul com o amido não hidrolisado. A atividade da amilase é inversamente proporcional à intensidade de cor azul e é calculada em comparação com um controle de substrato.
Valores de Referência
Soro: 60 a 160 U/dL
Urina: 50 a 140 U/h
2. Metodologia Cinética Colorimétrica (Método do Cloronitrofenol)
Fundamento químico
A α-amilase hidrolisa o substrato 2-cloro-4-nitrofenil-α-D-maltotriose (CNPG3), liberando 2- cloro-4-nitrofenol (CNP) e formando 2-cloro-4-nitrofenil-α-D-maltoside (CNPG2), maltotriose (G3) e glicose (G). A velocidade de formação do 2-cloro-4-nitrofenol é medida fotometricamente em 405 nm, possibilitando uma determinação direta da atividade da amilase na amostra analisada.
Valores de Referência
Soro: 22 a 80 U/L
Urina: até 320 U/L
Relação Amilase Urinária/Creatinina Urinária: até 400 U/g
Relação Depuração Amilase /Depuração Creatinina: 1,0 a 4,0%
2. LIPASE Sigla utilizada: LPS
Nome sistemático (IUB): Triacilglicerol acilhidrolase
Nome comum: Lipase
pH ótimo: 3,5 a 7,0
A lipase é uma enzima secretada pelo pâncreas para o duodeno para hidrólise dos triglicérides em seus constituintes, os ácidos graxos. A lipase é excretada por filtração através dos glomérulos renais. Após a filtração, a maior parte da enzima é reabsorvida pelos túbulos proximais dos rins e catabolizada em outro local. Assim como a amilase, a lipase aparece na corrente sanguínea após uma lesão das células acinares pancreáticas.
A determinação da lipase sérica é considerada por muitos como um teste muito sensível e específico para a pancreatite aguda, especialmente quando se emprega métodos que utilizam um cofator da lipase denominado colipase. O consenso na literatura, de um modo geral, é de que a dosagem da lipase é provavelmente um teste cerca de 10% menos sensível do que a amilase sérica, porém é cerca de 20 a 30% mais específico.
Na pancreatite aguda, os níveis de lipase normalmente acompanham os da amilase. Os níveis de lipase geralmente aumentam um pouco mais tarde do que os da amilase, começando dentro de 3-6 horas, atingindo o pico em 24-48 horas e, na maioria dos casos, retornam para a faixa de referência em 7-10 dias.
Os valores de lipase na pancreatite podem alcançar de 5-10 vezes o limite superior de referência, enquanto que nas outras doenças os níveis de lipase são sempre inferiores a 3 vezes os valores de referência.
Como a excreção da lipase é feita através dos rins, na insuficiência renal de uma maneira geral os níveis de lipase são altos. Infarto intestinal, colangite aguda e obstrução do intestino delgado são outras doenças que podem apresentar níveis altos de lipase sérica.
Valores elevados
As patologias que mais comumente apresentam valores elevados de lipase são: pancreatite aguda primária, pancreatite crônica recidivante, colecistite aguda, insuficiência renal, obstrução intestinal e infarto intestinal.
Amostra biológica
Sangue. Usar soro.
A atividade enzimática é estável 7 dias entre 15-25°C e 3 semanas entre 2-8°C.
Fatores interferentes
Drogas que podem provocar um aumento na lipase sérica são: betanecol, colinérgicos, codeína, indometacina, meperidina, metacolina, e morfina.
Os íons cálcio podem diminuir os níveis de lipase no soro e na urina.
Métodos de Dosagem
Há dois métodos gerais para a dosagem da lipase: titulométrico e turbidimétrico. Nos 2 métodos, o substrato utilizado é um triglicerídeo (trioleína) ou uma mistura de triglicerídeos (óleo de oliva). Este substrato é hidrolisado para diglicerídeos, monoglicerídeos e ácidos graxos livres.
1. Método Titulométrico
Fundamento Químico
Os ácidos graxos formados na hidrólise do substrato se dissociam em íons hidrogênio que são titulados diretamente.
2. Método Turbidimétrico Cinético no Ultravioleta: é o método mais empregado na rotina laboratorial.
Fundamento Químico
O substrato de emulsão de trioleína tamponado e estabilizado, na presença de ativadores e de colipase é hidrolisado pela lipase. Mede-se a velocidade da reação de hidrólise que é proporcional à atividade da lipase na amostra. A velocidade da reação é determinada através da diminuição da turbidez da emulsão (substrato) no ultravioleta.
Valores de Referência
Soro: até 200 U/L (25 ou 30°C)
ENZIMAS NAS DOENÇAS HEPÁTICAS
1. ALANINA AMINOTRANSFERASE Siglas: ALT - GPT - TGP
Nome sistemático (IUB)/Nome comum: Alanina aminotransferase
Nome antigo: Transaminase glutâmico-pirúvica
pH ótimo: 7,4
A alanina aminotransferase (ALT) ou transaminase glutâmico-pirúvica (GPT/TGP) é uma enzima encontrada predominantemente no fígado, em concentração moderada nos rins e em menores quantidades no coração e nos músculos esqueléticos. Na célula hepática, a ALT localiza-se no citoplasma (90%) e na mitocôndria (10%). Qualquer lesão (injúria) tissular ou doença afetando o parênquima hepático liberará uma maior quantidade da enzima para a corrente sanguínea, elevando os níveis séricos da ALT. Em geral, as causas mais comuns de elevação dos valores de ALT no sangue ocorrem por disfunção hepática. Desta maneira, a ALT além de ser sensível é também bastante específica para o diagnóstico de doença hepatocelular.
Convém ressaltar que uma lesão tecidual nos rins, coração e nos músculos esqueléticos também provocam uma maior liberação de ALT para a corrente sanguínea, elevando seus níveis séricos. Assim, diante de um quadro clínico de miosite ou de uma rabdomiólise grave, os valores de ALT podem elevar-se tanto quanto na hepatite virótica aguda.
Na hepatite virótica, na mononucleose infecciosa e na lesão hepatocelular induzida por drogas o grau e a freqüência da elevação dos níveis de ALT são praticamente os mesmos da AST. Já nos casos de cirrose ativa, hepatopatia alcoólica aguda, congestão hepática passiva, obstrução dos ductos biliares extra-hepáticos e tumor metastático do fígado, os níveis de ALT encontram-se frequentemente menos elevados do que os da AST.
A Relação AST/ALT (Índice DeRitis) tem sido empregado algumas vezes para auxiliar no diagnóstico diferencial das hepatopatias. Na hepatite virótica aguda, a Relação AST/ALT é sempre menor do que 1, enquanto que nas outras doenças hepatocelulares (cirrose, hepatites crônicas,etc) é sempre maior que 1.
Valores elevados
Os valores elevados de ALT são mais comumente verificados nas seguintes patologias: hepatites, cirrose, necrose hepática, colestase, isquemia hepática, tumor hepático, drogas hepatotóxicas, icterícia obstrutiva, miosite e pancreatite.
Amostra biológica
Sangue. Usar soro ou plasma colhido em EDTA ou heparina. Não utilizar amostras hemolisadas.
A atividade enzimática na amostra é estável por 4 dias entre 2 e 8°C e por 2 semanas quando conservada a 10°C negativos.
Fatores interferentes
Injeções intramusculares anteriores ao teste podem elevar os níveis de ALT.
Algumas drogas que podem elevar os níveis de ALT são: anticoncepcionais orais, acetaminofen, allopurinol, ácido aminosalicílico, ácido nalidíxico, ampicilina, azatioprina, carbamazepina, clofibrato, cefalosporinas, codeína, clordiazepóxido, clorpropamida, cloxacilina, dicumarol, fenilbutazona, fenotiazinas, fenitoína, indometacina, isoniazida, metildopa, nitrofurantoína, oxacilinas, procainamida, propoxifeno, propanolol, quinidina, salicilatos, tetraciclinas e verapamil.
Métodos de Dosagem
1. Metodologia Cinética no Ultravioleta Otimizada
Fundamento Químico
A alanina aminotransferase (ALT) catalisa a transferência do grupo amina da alanina para o cetoglutarato com formação de glutamato e piruvato. O piruvato é reduzido a lactato por ação da lactato desidrogenase (LDH), enquanto que a coenzima NADH é oxidada a NAD+. A atividade enzimática da ALT na amostra é calculada com base na redução da absorbância em 340 ou 365 nm, quando o NADH se transforma em NAD+.
Valores de Referência
Soro ou plasma
Até 41 U/L na temperatura de 37°C
Até 29 U/L na temperatura de 30°C
2. Metodologia Cinética Colorimétrica de Tempo Fixo (Método de Reitman e Frankel)
Fundamento Químico
A alanina aminotransferase (ALT) catalisa a transferência do grupo amina da alanina para o cetoglutarato com formação de glutamato e piruvato. O piruvato formado reage com a 2-4-dinitrofenilhidrazina formando a hidrazona que adquire coloração máxima pela adição de hidróxido de sódio. A intensidade de coloração é proporcional à atividade enzimática da amostra.
Valores de Referência
Soro ou plasma: 4 a 32 Unidades/mL.
Conversão de Unidade Reitmam-Frankel (U/mL) para Unidade Internacional (U/L)
Unidades Reitman-Frankel U/mL X 0,482 = U/L
2. ASPARTATO AMINOTRANSFERASE
Siglas utilizadas: AST - GOT - TGO
Nome sistemático (IUB)/Nome comum: Aspartato aminotransferase
Nome antigo: Transaminase glutâmico-oxalacética
pH ótimo: 7,4
A aspartato aminotransferase (AST) ou transaminase glutâmico-oxalacética (GOT/TGO) é uma enzima encontrada em concentração muito alta no músculo cardíaco, no fígado, músculos esqueléticos e em menor concentração nos rins e pâncreas. Nas células hepáticas, a AST localiza-se no citoplasma (40%) e na mitocôndria (60%). Qualquer lesão tissular ou doença afetando o parênquima hepático liberará uma maior quantidade da enzima para a corrente sanguínea, elevando os níveis séricos da AST. Sempre que ocorrer uma lesão hepatocelular de qualquer etiologia haverá uma grande liberação da enzima AST para a corrente sanguínea, elevando seus níveis séricos.
Na hepatite virótica aguda, os níveis de AST encontram-se quase sempre elevados em mais de 10 vezes o limite superior da faixa de referência e em alguns casos ultrapassam a 20 vezes esse limite superior de normalidade. Entretanto, dentro de uma a duas semanas, os valores de AST diminuem bastante podendo cair para a faixa normal ou apresentar ligeiro aumento.
Nos casos de obstrução extra-hepática, as elevações de AST não são comuns, mas podem ocorrer quando há lesão parenquimatosa secundária aguda. Na cirrose, as alterações da AST e seus respectivos níveis vão depender da ocorrência e do grau de lesão hepatocelular ativa presente. Geralmente, na cirrose inativa os valores de AST não se alteram. Na cirrose alcoólica ativa, os valores de AST se elevam moderadamente.
Na hepatite virótica crônica ativa, os níveis de AST também encontram-se elevados moderadamente. Várias doenças comuns apresentam elevação pequena ou moderada de AST, e entre elas podemos citar: mononucleose infecciosa, hepatite aguda na fase de remissão ou recuperação, hepatite crônica, disfunção hepática induzida por drogas, tumor hepático metastático, congestão hepática passiva, cirrose ativa ou hepatopatia alcoólica, obstrução extra-hepática prolongada do ducto biliar, fígado gorduroso e citomegalovirus.
Na maioria das vezes, a dosagem de AST é realizada juntamente com a ALT e a Relação AST/ALT pode ser determinada para auxiliar no diagnóstico diferencial das doenças.
Assim, a Relação AST/ALT é sempre maior do que 1 em pacientes com cirrose alcoólica, hepatites crônicas, congestão hepática e tumor metastático do fígado. Geralmente, essa relação é menor do que 1 nos casos de hepatite virótica aguda e mononucleose infecciosa. Nos casos de lesão do miocárdio, a AST juntamente com a dosagem da creatina quinase (CK) e da desidrogenase láctica (LDH) é muito útil para o diagnóstico e acompanhamento do infarto do miocárdio (IM). Os níveis de AST aumentam dentro de 6 a 10 horas após o infarto, atingindo um valor máximo em 12 a 48 horas, voltando aos níveis normais em 3 a 4 dias, se não ocorrer novo infarto. Portanto, as determinações em série da AST como da CK, são muito úteis para a avaliação do infarto do miocárdio. No entanto, a AST é muito menos específica do que a CK-MB para o diagnóstico do infarto do miocárdio.
Nos casos de pericardite, angina e cardite reumática não há aumento dos níveis de AST.
Valores elevados
Os valores elevados de AST são mais comumente encontrados nas seguintes patologias: hepatites, cirrose hepática, necrose hepática, metástase hepática, drogas hepatotóxicas, processo infiltrativo hepático (tumor), infarto do miocárdio, operações cardíacas, angioplastia e cateterização cardíaca, pancreatite aguda, trauma muscular esquelético, queimaduras graves, anemia hemolítica aguda, distrofia muscular progressiva, mononucleose infecciosa com hepatite, doenças musculares primárias (miopatia, miosite), doença renal aguda e convulsões recentes.
Amostra biológica
Sangue. Usar soro ou plasma colhido em EDTA ou heparina. Não utilizar amostras hemolisadas.
A atividade enzimática na amostra é estável por 4 dias entre 2 e 8°C e por 2 semanas a 10°C negativos.
Fatores interferentes
Injeções intramusculares anteriores ao teste podem elevar os níveis de AST.
Exercícios podem provocar aumentos nos níveis de AST.
Algumas drogas que podem elevar os níveis de AST são: anticoncepcionais orais, antihipertensivos, agentes colinérgicos, anticoagulantes tipo-cumarina, drogas hepatotóxicas, eritromicina, isoniazida, metildopa, opiáceos, preparações digitálicas, salicilatos e verapamil.
Métodos de Dosagem
1. Metodologia Cinética no Ultravioleta Otimizada
Fundamento Químico
A aspartato aminotransferase (AST) catalisa a transferência do grupo amina do aspartato para o cetoglutarato com formação de glutamato e oxaloacetato. O oxaloacetato é reduzido a malato por ação da malato desidrogenase (MDH), enquanto que a coenzima NADH é oxidada a NAD+. A atividade enzimática da AST na amostra é calculada com base na redução da absorbância em 340 ou 365 nm, quando o NADH se transforma em NAD+.
Valores de Referência
Soro ou plasma:
Até 42 U/L na temperatura de 37°C
Até 27 U/L na temperatura de 30°C
2. Metodologia Cinética Colorimétrica de Tempo Fixo (Método de Reitman e Frankel)
Fundamento Químico
A aspartato aminotransferase (AST) catalisa a transferência do grupo amina do aspartato para o cetoglutarato com formação de glutamato e oxaloacetato. O oxaloacetato formado reage com a 2-4-dinitrofenilhidrazina formando a hidrazona que adquire coloração máxima pela adição de hidróxido de sódio. A intensidade de coloração é proporcional à atividade enzimática da amostra.
Valores de Referência
Soro ou plasma: 4 a 36 Unidades/mL.
Conversão de Unidade Reitmam-Frankel (U/mL) para Unidade Internacional (U/L):
Unidades Reitman-Frankel U/mL X 0,482 = U/L
3.FOSFATASE ALCALINA
Siglas utilizadas: ALP - FALC
Nome sistemático (IUB): Fosfohidrolase monoéster ortofosfórica
Nome comum: Fosfatase alcalina
pH ótimo: 8,5 a 10,3
A fosfatase alcalina compreende um grupo de enzimas fosfohidrolases que apresentam atividade máxima em pH alcalino, próximo de 10. A enzima é encontrada em vários tecidos, com maiores concentrações no fígado, no epitélio do trato biliar e no osso. A mucosa intestinal e a placenta contêm também a fosfatase alcalina. A fosfatase alcalina apresenta várias isoenzimas, sendo que cada uma das fontes produtoras contém uma isoenzima específica. O fracionamento das isoenzimas da ALP é útil para diferenciar doenças ósseas de doenças hepáticas. As isoenzimas são melhor estudadas pelo teste de estabilidade ao calor e pelo fracionamento eletroforético. A isoenzima de origem hepática (ALP1) é termoestável, enquanto que fração óssea (ALP2) é inativada pelo calor.
A determinação laboratorial da fosfatase alcalina (ALP) se aplica muito bem para o diagnóstico de doenças do fígado e dos ossos.
No fígado, a ALP é secretada pelos hepatócitos (células de Kupffer) e pelas células da mucosa do trato biliar. Geralmente, qualquer hepatopatia ativa pode aumentar os valores da ALP, mas as maiores elevações nos níveis da enzima ocorrem nos casos de obstrução do trato biliar. Desse modo, a fosfatase alcalina estará muito aumentada nas obstruções biliares intra ou extra-hepáticas e também na cirrose.
Nos casos de tumores hepáticos, hepatites e drogas hepatotóxicas as elevações da enzima são menores.
Nos ossos, os osteoblastos respondem pela secreção da fosfatase alcalina e qualquer aumento na atividade osteoblástica corresponderá elevação nos níveis da enzima no soro.
Por essa razão, no crescimento ósseo normal da infância e adolescência, na fase de consolidação de fraturas, na doença de Paget, no hiperparatireoidismo, na osteomalácia, no raquitismo e no carcinoma osteoblástico com metástase há aumento nos níveis séricos da fosfatase alcalina.
Valores elevados
Cirrose, obstrução biliar intra e extra-hepática, tumor primário ou metastático do fígado, tumor metastático do osso, recuperação de fraturas ósseas, doença de Paget, hiperparatireoidismo, fases de crescimento normal dos ossos.
Valores Diminuídos
Hipotireoidismo, hipofosfatemia, desnutrição, doença celíaca.
Amostra biológica
Sangue. Usar soro ou plasma colhido com heparina.
A atividade enzimática é estável por 7 dias entre 2-8°C e por vários meses a 20°C negativos.
Fatores interferentes
Os níveis de ALP podem estar aumentados após uma ingestão recente de alimentos, sendo obrigatório portanto, o jejum para a coleta do sangue.
As drogas que podem provocar um aumento da ALP são: ácido nicotínico, allopurinol, antibióticos, azatioprina, colchicina, fluoretos, indometacina, isoniazida, metildopa, metotrexato, probenicide, tetraciclinas e verapamil.
As drogas que podem provocar uma diminuição da ALP são: arsenicais, cianetos, fluoretos, nitrofurantoína, oxalatos e sais de zinco.
Métodos de Dosagem
Por causa da diversidade de substratos disponíveis, na literatura há registros de uma grande variedade de métodos que podem ser empregados para a dosagem da fosfatase alcalina.
Atualmente, os métodos mais indicados são os que usam como substrato o paranitrofenilfosfato.
1. Metodologia Cinética Colorimétrica (Método do Paranitrofenol)
Fundamento Químico
Em pH alcalino, a fosfatase alcalina (FALC) catalisa em meio alcalino a transferência do grupo fosfato do p-nitrofenilfosfato para o 2-amino-2-metil-1-propanol (AMP), liberando o para-nitrofenol (amarelo). A atividade catalítica é determinada a partir da velocidade de formação do p-nitrofenol, medida em 405 nm.
Valores de Referência para Soro ou Plasma:
Adultos: 26 a 117 U/L
2. Metodologia Cinética Colorimétrica de Tempo Fixo (Método de Roy mod.)
Fundamento Químico
A fosfatase alcalina do soro hidrolisa o substrato de timolftaleína monofosfato, liberando timolftaleína e fosfato inorgânico. Pela adição de álcali, a ação enzimática é inibida e a timolftaleína adquire cor azul, cuja absorbância é medida fotometricamente. O produto final da reação se constitui de uma mistura de cor azul e a cor própria do substrato.
Valores de Referência
Soro ou plasma
Adultos: 13 a 43 U/L.
Crianças até 12 anos: 56 a 156 U/L
4. GAMAGLUTAMIL TRANSFERASE
(GAMAGLUTAMIL TRANSPEPTIDASE)
Siglas utilizadas: GGT - γ-GT - GGTP -γ -GTP
Nome sistemático: γ-Glutamil transferase
Nome comum: γ-Glutamil transpeptidase
pH ótimo: 8,0 a 8,5
A GGT é uma enzima localizada predominantemente nos hepatócitos, em menor concentração nos rins e, em concentração bem menor no epitélio do trato biliar, no intestino, coração, pâncreas, baço e cérebro. A principal função dessa enzima é catalisar a transferência de amino ácidos e peptídeos através das membranas celulares.
Os recém-nascidos apresentam valores altos de GGT que decaem para valores do adulto, em torno de 4 meses de vida. Já foi constatado, através de estudos, que os indivíduos obesos apresentam níveis de GGT mais altos do que as pessoas não obesas.
As doenças hepáticas ativas compreendem as causas mais comuns de elevação da GGT. Os níveis de GGT são afetados tanto pela lesão hepatocelular aguda quanto pela obstrução do trato biliar. Desse modo, a determinação da GGT é empregada no diagnóstico das doenças hepáticas e é muito específica para indicar uma colestase. Nesses quadros clínicos, os níveis de GGT acompanham os da fosfatase alcalina (ALP), porém a GGT é mais sensível e também não se eleva nas doenças ósseas como a fosfatase alcalina. Um paciente apresentando GGT normal com ALP alta indica uma doença óssea, enquanto uma GGT alta com ALP alto indica uma doença hepática.
Devido à lesão hepática concomitante, a GGT encontra-se também aumentada nos casos de tumor hepático e de mononucleose infecciosa.
Outro aspecto clínico importante da GGT é a sua utilização para detectar a ingestão de álcool, uma vez que ela pode aumentar mesmo após pequenas doses de bebida. De acordo com a literatura, cerca de 75% dos bebedores inveterados e alcoólatras crônicos apresentam níveis altos de GGT. Atualmente, a dosagem da GGT é recomendada como método de triagem para o alcoolismo.
Valores elevados
Valores elevados de γ-GT são mais comumente encontrados nas seguintes patologias: hepatite, cirrose, necrose hepática, tumor hepático, colestase, drogas hepatotóxicas, ingestão alcoólica, icterícia, pancreatite, isquemia hepática, infarto do miocárdio (4-10 dias após) e insuficiência cardíaca congestiva.
Amostra biológica
Sangue. Usar soro ou plasma colhido com heparina ou com EDTA. Anticoagulantes contendo citrato, fluoreto ou oxalato inibem a atividade da GGT.
A atividade enzimática é estável por 7 dias entre 2-8°C e por vários meses a 10 C negativos.
Fatores interferentes
Os valores da GGT podem estar diminuídos na fase final da gravidez.
As drogas que podem aumentar os níveis da GGT são: álcool, fenobarbital e fenitoína (Dilantina).
As drogas que podem diminuir os níveis da GGT são: anticoncepcionais orais, citrato, clofibrato, fluoreto e oxalato.
Método de Dosagem
Metodologia Cinética Colorimétrica (Método de Szass mod.)
Fundamento Químico
A γ-glutamiltransferase (GGT) catalisa a transferência do grupamento glutamil da γ-glutamil- 3-carboxi-4-anilida para a glicilglicina, formando γ-glutamilglicilglicina e 3-carboxi-4- nitroanilina, que tem elevada absorbância em 405 nm.
A quantidade de liberada é diretamente proporcional à atividade da GGT na amostra.
A atividade catalítica da GGT é determinada a partir da velocidade de formação da 3-carboxi-
4-nitroanilina.
Valores de Referência para soro ou plasma:
37°C
Mulheres Até 38 U/L
Homens Até 55 U/L
5. COLINESTERASE
Siglas utilizadas: CHE - CHS
Nome sistemático (IUB): Acil colina acil-hidrolase
Nome comum: Colinesterase/Pseudocolinesterase
pH ótimo: 7,8 - 8,6
A colinesterase é uma enzima com a função de catalisar a hidrólise da acetilcolina e outras colinas, regulando a transmissão do impulso nervoso na sinapse do nervo e na junção neuromuscular. Dois tipos de colinesterase são determinadas: acetilcolinesterase (colinesterase verdadeira) e pseudocolinesterase. Enquanto a acetilcolinesterase (acetilcolina hidrolase) é encontrada nas hemácias e terminações de nervos colinérgicos, a pseudocolinesterase (butirilcolinesterase) encontra-se no plasma, fígado, músculo liso e adipócitos. A colinesterase verdadeira tem afinidade pela acetilcolina, enquanto a pseudocolinesterase caracteriza-se por catalisar a hidrólise da butirilcolina.
Valores diminuídos de CHE são encontrados nas doenças hepáticas crônicas, devido à diminuição da síntese enzimática do fígado.
Na hepatite aguda e na hepatite crônica de longa duração há uma diminuição de 30 a 40% da atividade enzimática.
Na cirrose avançada e no carcinoma hepático, a diminuição da síntese enzimática atinge valores de 50 a 70%. Por essa razão, a CHE é considerada uma enzima indicadora de síntese hepática.
Valores diminuídos de CHE são também verificados nos envenenamentos por inseticidas organofosforados, os quais atuam como inibidores da enzima.
Valores diminuídos
Valores diminuídos de CHE são encontrados nas seguintes situações: no envenenamento por inseticidas organofosforados, doença hepatocelular, desnutrição e em pessoas com deficiência congênita de enzimas.
Amostra biológica
Sangue. Usar soro ou plasma colhido com heparina ou com EDTA. Anticoagulantes contendo citrato, fluoreto ou oxalato inibem a atividade da CHE.
A atividade enzimática é estável por 7 dias entre 2-8°C.
Fatores interferentes
Os valores da CHE podem estar diminuídos durante a gravidez.
As drogas que podem diminuir os níveis da CHE são: anticoncepcionais orais, atropina, cafeína, codeína, estrógenos, fenotiazinas, sulfato de morfina, teofilina, quinidina e vit. K.
Método de Dosagem
Metodologia Cinética Colorimétrica
Fundamento Químico
A CHE sérica ou plasmática catalisa a hidrólise dos ésteres de colina, como o S-butirilcolina em pH 7,7. A tiocolina liberada reage com o ácido 5,5´-ditiobis-2-nitrobenzoico (DTNB) formando um composto de cor amarela diretamente proporcional à atividade enzimática, que é medido fotometricamente em 405 nm.
Valores de Referência para Soro ou plasma:
ENZIMAS NAS DOENÇAS CARDÍACAS
1. CREATINOQUINASE (CK)
(ADENOSINA TRIFOSFATO: CREATINA N-FOSFOTRANSFERASE
Siglas utilizadas: CK – CPK (desuso)
Nome sistemático (IUB): ATP Creatino N-fosfotransferase
Nome comum: Creatinoquinase
pH ótimo: 6,8 no sentido da formação de ATP com o substrato de creatinofosfato e 9,0 no sentido da fosforilação da creatina com o substrato de creatina.
A Creatinoquinase (CK) é encontrada no músculo cardíaco, na musculatura esquelética e no cérebro. Deste modo, qualquer lesão nas células desses órgãos provocará um aumento nos níveis séricos de CK. De acordo com a literatura, a enzima encontra-se aumentada numa faixa de 65-100% dos pacientes com infarto agudo do miocárdio. No infarto do miocárdio, a CK comporta-se de modo semelhante à AST, porém as doenças hepatocelulares que produzem elevações da AST não exercem nenhum efeito sobre a CK.
Os valores de CK no soro podem estar alterados em várias condições clínicas associadas a lesão muscular aguda ou a esforço muscular intenso. Portanto, os níveis de CK encontram-se normalmente altos na miosite, distrofia muscular, traumatismo muscular, após exercício moderadamente intenso, após cirurgia e no delirium tremens ou nas convulsões.
Níveis altos de CK podem ser encontrados nos casos de alcoolismo acentuado, devido ao efeito do álcool sobre os músculos.
A CK encontra-se também quase sempre elevada após injeções intramusculares.
Em relação ao diagnóstico do infarto do miocárdio, a dosagem da CK total apresenta alguns
inconvenientes a saber:
· falta de especificidade, devido a elevações falso-positivas em conseqüência de lesão dos músculos esqueléticos, principalmente nas injeções intramusculares.
· período de tempo relativamente curto em que a enzima permanece alta após o início do infarto.
Isoenzimas da Creatinoquinase (CK)
A CK total pode ser separada em 3 frações principais, denominadas de CK-BB (CK1), CK-MB (CK2) e CK-MM (CK3). Atualmente, os laboratórios já podem dispor de métodos adequados para a determinação das isoenzimas da CK.
1. Isoenzima CK-BB
É encontrada predominantemente no cérebro e no pulmão, sendo que uma elevação dos seus níveis não é comum.
A CK-BB pode estar elevada em algumas condições como após embolia pulmonar e em alguns pacientes com carcinoma de próstata e pulmão. Já nos casos de distúrbios cerebrais, nos quais teoricamente deveria ser liberada a isoenzima CK-BB, o comum tem sido encontrar no soro a isoenzima CK-MM.
2. Isoenzima CK-MM
Compreende mais de 95% da CK dos músculos esqueléticos e cerca de 70-75% da enzima do miocárdio. Considerando que a quantidade de músculo esquelético do corpo é muito superior à do miocárdio, consequentemente a elevação dos níveis de CK-MM no soro será devido a uma lesão ou hipóxia do músculo esquelético, incluindo exercício intenso, convulsões, traumatismo, inflamação, distrofia muscular ou injeção intramuscular. Podem ser observados aumentos também da fração MM de CK nos casos de hipotireoidismo e hipocalemia atingindo os músculos.
3. Isoenzima CK-MB
É uma fração híbrida composta de cadeias M e B, que é encontrada predominantemente no músculo cardíaco. A sua determinação é bastante específica para o diagnóstico do infarto do
miocárdio. A CK-MB aumenta dentro de 3-6 horas após ocorrência do infarto, atingindo um valor máximo em 12-24 horas e retornando ao normal em 24-48 horas, caso não ocorra um novo infarto nesse período. Existe uma correlação grosseira entre o grau de elevação da enzima e a extensão do infarto.
Valores elevados de CK Total
Infarto agudo do miocárdio, distrofia muscular, delirium tremens, infarto pulmonar, doença vascular cerebral aguda, convulsões, alcoolismo crônico, poliomiosite, choque elétrico, hipocalemia, dermatomiosite e trauma do sistema nervoso central.
Valores elevados da Isoenzima CK-BB
Infarto pulmonar, lesão cerebral, acidente vascular cerebral, choque, embolia pulmonar, hemorragia subaracnóide e câncer no cérebro.
Valores elevados da Isoenzima CK-MM
Distrofia muscular, miosite, convulsões recentes, cirurgia recente, hipotireoidismo, hipocalemia, injeções intramusculares, e delirium tremens.
Valores elevados da Isoenzima CK-MB
Infarto agudo do miocárdio, defibrilação cardíaca, isquemia cardíaca, miocardite, cirurgia de aneurisma cardíaco, distrofia muscular e rabdomiólise.
Amostra biológica
Sangue. Usar soro ou plasma colhido com EDTA ou heparina. Evitar exposição à luz solar intensa. A atividade enzimática é estável por 24 horas entre 15 - 25 C e 7 dias entre 2 – 8°C.
Não usar amostras hemolisadas.
Fatores interferentes
Injeções intramusculares , exercícios intensos ou moderados e cirurgia recente podem elevar os níveis de creatinoquinase (CK).
Drogas que podem provocar um aumento da CK no soro são: ampicilina, anfotericina B, álcool, alguns anestésicos, aspirina, captropil, colchicina, clofibrato, dexametasona (decadron), furosemida (lasix), lovostatin, lítio, lidocaína, morfina, propanolol e succinilcolina.
Método de Dosagem da CK Total
Metodologia Cinética no Ultravioleta
Fundamento Químico
A CK catalisa a reação entre creatina fosfato e adenosina difosfato (ADP) formando creatina e adenosina trifosfato (ATP). A glicose é fosforilada pelo ATP sob a ação da hexoquinase (HK) formando glicose-6-fosfato, que é oxidada a 6-fosfogluconato (6-PG) pela glicose-6- fosfato-desidrogenase (G-6-PDH) na presença de NAD+. Uma quantidade equimolar de NAD+ é reduzida a NADH, ocorrendo um aumento da absorbância em 340 ou 365 nm, proporcional à atividade da CK na amostra.
Valores de Referência para soro ou plasma:
Método de Dosagem da Isoenzima CK-MB
Metodologia Cinética no Ultravioleta
Fundamento Químico
As subunidades M da creatinoquinase (CK) são inibidas por um anticorpo específico que não afeta as subunidades B. A concentração catalítica de CK-B, que corresponde à metade da atividade da CK-MB, é determinada pelas reações acopladas da hexoquinase (HK) e glicose- 6-fosfato desidrogenase (G6P-DH). Uma quantidade equimolecular de NADP+ é reduzida para NADPH, havendo um aumento da absorbância em 340 nm proporcional à atividade catalítica de CK.
Valores de Referência para soro ou plasma:
Temperatura 37 C
Valores Até 25 U/L
2. DESIDROGENASE LÁCTICA
(LACTATO DESIDROGENASE)
Siglas utilizadas: LDH - LD
Nome sistemático (IUB): L-Lactato NAD-óxido-redutase
Nome comum: Lactato desidrogenase/Desidrogenase láctica
pH ótimo: 8,8 a 9,8 no sentido da formação de ácido pirúvico com o substrato de ácido lático e 7,4 a 7,8 no sentido da formação de ácido lático com o substrato de ácido pirúvico.
A desidrogenase láctica (LDH) é encontrada em vários tecidos como coração, hemácias, fígado, músculo esquelético, rim, cérebro, pulmões e tecido linfóide. Desse modo, os valores de LDH total estarão altos em uma variedade de situações clínicas. Devido à sua distribuição diversificada pelos tecidos, a dosagem da LDH total não é um indicador específico nem de doenças hepáticas nem de doenças cardíacas. Porém, quando determinada conjuntamente com outras enzimas, ou quando fracionada em isoenzimas, torna-se bastante útil para o diagnóstico dessas patologias.
Valores elevados de LDH total são observados em uma variedade de condições clínicas.
Os níveis mais altos são encontrados em pacientes com anemia megaloblástica, em carcinomas e no choque grave. Elevações moderadas ocorrem em pacientes com infarto do miocárdio, infarto pulmonar, anemia hemolítica, leucemia, mononucleose infecciosa e nos pacientes com distrofia muscular progressiva. Alterações pequenas da LDH total são encontradas em pacientes com hepatite aguda, nas icterícias obstrutivas e na cirrose.
Valores elevados são também encontrados no delirium tremens.
Isoenzimas da LDH
A origem principal da frações de LDH é a seguinte:
§ LDH1: coração, hemácias e rins.
§ LDH2: coração e sistema retículo endotelial.
§ LDH3: pulmões e outros tecidos.
§ LDH4: placenta e pâncreas.
§ LDH5: fígado e músculos esqueléticos.
São vários os métodos que podem ser utilizados para o fracionamento da LDH, porém a eletroforese e o teste do calor são os mais empregados. O aquecimento a 60°C por 30 minutos inativa 3 frações, deixando intactas as frações 1 e 2, de origem cardíaca que são termo-estáveis.
Pela eletroforese, o perfil mostra que as frações LDH1 e LDH2 (cardíacas) são mais rápidas frente ao ânodo (polo positivo), enquanto que a LDH5 (hepática) é a mais lenta, permanecendo próxima ao ponto de aplicação. Existem ainda métodos imunológicos específicos para a dosagem da LDH1.
A determinação laboratorial da desidrogenase hidroxibutírica (HBDH) é também utilizada para substituir a dosagem da LDH1, pois os seus valores se equivalem clinicamente.
Aplicação Clínica do Fracionamento da LDH
1. Infarto Agudo do Miocárdio: há elevação moderada da LDH1 e pequena da LDH2 nas primeiras horas após o infarto, atingindo o pico em 48-72 horas, retornando aos níveis de referência dentro de 10-14 dias. Uma relação LDH1/LDH2 maior do que 1 é uma informação bastante indicativa de infarto do miocárdio.
2. Doenças Hepáticas: ocorre aumento das frações LDH4 (moderado) e LDH5 (acentuado) nas hepatites agudas, icterícias obstrutivas e cirrose.
3. Doenças do Sistema Nervoso Central: nas meningites e tumores malígnos há aumento nas frações LDH2 e LDH3.
4. Doenças Malígnas: havendo metástase, verifica-se aumento das frações LDH2, LDH3 e LDH4.
5. Distrofia Muscular: elevação de LDH1, LDH2 e LDH3.
6. Anemia Megaloblástica: aumento acentuado de LDH1.
7. Anemia Aplástica: todas as frações se elevam devido à destruição das hemácias e leucócitos.
Valores elevados de LDH total
As causas mais comuns de elevação da LDH total são: infarto do miocárdio, infarto pulmonar, hepatite, cirrose, icterícias obstrutivas, distrofia muscular, anemias, doenças do parênquima renal, tumores, acidente vascular cerebral.
Amostra biológica
Sangue. Usar soro que deve ser separado até 1 hora após a colheita. O analito é estável por 4 dias entre 15-25°C. Refrigeração e/ou congelamento da amostra podem desnaturar determinadas isoenzimas.
Não usar amostras hemolisadas.
Líquor. O analito é estável por 6 horas entre 15-25°C. A amostra deve ser centrifugada.
Fatores interferentes
A hemólise pode provocar um aumento falso-positivo nos níveis da LDH.
As drogas que podem causar um aumento da LDH são: álcool, anestésicos, aspirina, clofibrato, fluoretos, mitrimicina, narcóticos e procainamida.
O ácido ascórbico pode provocar uma diminuição no valor da LDH.
Métodos de Dosagem da LDH Total
Existem métodos colorimétricos, fluorimétricos e espectrofotométricos para a dosagem da LDH total.
1. Metodologia Cinética no Ultravioleta (Método Piruvato-Lactato)
Fundamento Químico
Nas condições do ensaio, a desidrogenase láctica (LDH) catalisa a conversão do piruvato para lactato, enquanto o NADH é oxidado para NAD+. Determina-se o decréscimo da absorbância em 340 nm, que é proporcional à atividade de LDH na amostra analisada.
Valores de Referência para soro ou plasma:
2. Metodologia Cinética Colorimétrica de Tempo Fixo (Método Lactato-Piruvato
Fundamento Químico
A desidrogenase láctica (LDH) catalisa a oxidação do lactato para piruvato. Na mesma reação, o NAD+ é reduzido a NADH + H+ que, em uma reação acoplada, reduz estequiometricamente o INT (cloreto de iodofenil-nitrofenil tetrazolio) a formazan, com o PMS (metasulfato de fenazina) agindo como um transportador intermediário de elétron. A absorbância do formazan de cor vermelha formado, medida em 500 nm, é diretamente proporcional à atividade de LDH na amostra.
Valores de Referência
Soro: 80 a 240 U/L
Líquor: 5 a 33 U/L
Métodos de Dosagem das Isoenzimas da LDH
A eletroforese em acetato de celulose ou em agarose são os melhores processos para se fazer o fracionamento e quantificação das frações da LDH.
A isoenzima LDH1 pode ser determinada diretamente através de técnicas imunoquímicas, usando anticorpos específicos para a LDH1.
Pode-se fazer também uma quantificação aproximada da LDH1, usando o princípio da termoestabilidade. Enquanto a fração LDH1 resiste a uma desnaturação a 65°C por 30 minutos, as outras isoenzimas são destruídas nessas condições. O processo compreende a dosagem da LDH total antes e após submeter a amostra a 65 C por 30 minutos.
O valor de LDH1 pode também ser estimado por meio da dosagem da desidrogenase hidroxibutírica (HBDH), já que sua atividade é reconhecida representar a LDH1.
1.Metodologia Eletroforética em Acetato de Celulose
Fundamento Químico
As isoenzimas são separadas por eletroforese e a revelação e quantificação é processada através do substrato (lactato + NAD+) e do reagente de cor (INT + PMS), com leitura fotométrica em 500 nm.
Valores de Referência das Isoenzimas no soro ou plasma
LDH1 17 - 27%
LDH2 27 - 37%
LDH3 18 - 25%
LDH4 3 - 8%
LDH5 0 - 5%
2. Dosagem da HBDH
A dosagem da HBDH pode ser empregada para substituir a determinação da isoenzima cardíaca (LDH1). Na verdade, a HBDH compreende a LDH total que é colocada para atuar sobre um substrato de ácido α-cetobutírico em lugar do substrato de ácido láctico ou pirúvico.
Nessas condições, a medida da atividade da HBDH determina indiretamente a atividade da LDH1 (cardíaca).
Fundamento Químico
Em reação catalisada pela α-HBDH (desidrogenase hidroxibutírica), o ácido α-cetobutírico é reduzido a ácido α-hidroxibutírico enquanto o NADH é oxidado a NAD+. A velocidade da reação é medida através do decréscimo da absorbância do NADH no ultravioleta.
Valores de Referência: 60 a 140 U/L (Soro)
3. ASPARTATO AMINOTRANSFERASE (AST) – Descrito acima
MARCADORES BIOQUÍMICOS DO INFARTO AGUDO DO MIOCÁRDIO
As doenças cardiovasculares constituem um grave problema de saúde pública, pois correspondem a cerca de 50% de todas as mortes ocorridas no mundo e 1/3 desses óbitos ocorre na faixa etária de 35 a 65 anos de idade. Elas têm ainda uma alta correlação com o grau de desenvolvimento do país e a sua prevalência é maior nos países industrializados.
Dentre as doenças cardiovasculares, a Doença Arterial Coronariana (DAC) ou Doença Coronariana Isquêmica (DCI) que provoca o Infarto Agudo do Miocárdio (IAM), considerado a principal causa de morte nos países industrializados, atingindo principalmente a população economicamente ativa e de melhor nível sócio-econômico.
De acordo com a Organização Mundial de Saúde (OMS), ocorrem no mundo cerca de 7,2 milhões de óbitos por ano devido à DAC.
Em 1996, somente nos EUA 9,2 milhões de pessoas apresentaram sintomas relacionados com essa patologia e, incontestavelmente, o Infarto Agudo do Miocárdio (IAM) é a sua maior conseqüência.
No Brasil, segundo o Ministério da Saúde, é evidente um aumento significativo no número de casos de DAC nas últimas 5 décadas.
Dessa maneira, é extremamente importante que o diagnóstico da DAC seja estabelecido o mais cedo possível para o definição de uma terapia adequada e melhoria da sobrevida dos pacientes.
Em relação aos marcadores bioquímicos do IAM, tem-se observado na literatura uma evolução constante procurando sempre valorizar mais aqueles marcadores de maior especificidade e maior sensibilidade.
Nos estudos sobre os marcadores deve-se conhecer os sítios fisiológicos de cada um para evitar falsas interpretações diagnósticas, principalmente quando um marcador é originário de diferentes órgãos. É importante ainda, conhecer o menor tempo para o marcador se elevar na corrente sanguínea e o tempo que o mesmo leva para retornar aos valores de referência.
Esse intervalo é denominado de janela diagnóstica. É também importante saber o tempo que o marcador atinge o valor máximo no sangue.
Para um melhor entendimento, pode-se classificar os marcadores bioquímicos da DAC em:
MARCADORES CLÁSSICOS
1.AST/GOT (Aspartato Aminotransferase/Transaminase Glutâmico-Oxalacética)
A determinação de AST como marcador de IAM foi descrita no início da década de 50.
Posteriormente, foi sendo substituída gradualmente pela CK, que é um marcador mais precoce e mais específico. Nos dias de hoje, a dosagem da AST/GOT como marcador de IAM, praticamente não é mais empregada.
2.LDH (Desidrogenase Láctica/Lactato Desidrogenase)
A dosagem de LDH na rotina do laboratório clínico teve início na década de 70. Em comparação com a AST, a LDH tem a vantagem de ser mais sensível.
Por ser composta de 5 sub-unidades (isoenzimas), a LDH necessita que se faça o racionamento para a dosagem da fração cardíaca LDH1 e, caso o paciente tenha lesões no parênquima renal ou doença hemolítica, pode-se obter resultados falso positivos para o IAM devido ao efeito cumulativo que lesões nesses órgãos apresentam. Além do mais, a LDH apresenta uma janela diagnóstica tardia, se confrontada com os novos marcadores.
Assim como a AST, ultimamente a dosagem da LDH tem sido preterida como marcador
bioquímico de IAM.
3.CK/CPK (Creatinoquinase/Adenosina Trifosfato: Creatina N-Fosfotransferase)
Dentre os marcadores clássicos do IAM, a dosagem de CK-MB é a mais indicada. É recomendável a solicitação de dosagem de CK-MB juntamente com CK Total com o objetivo de poder identificar frações séricas atípicas.
A CK é um dímero composto de 2 sub-unidades, cada uma com um PM de 40.000. As sub-unidades M (músculo) e as B (cérebro) são produtos de 2 gens estruturais distintos.
Desse modo, 3 pares diferentes de sub-unidades podem existir: CK-BB (CK1), CK-MB (CK2) e CK-MM (CK3) e atualmente, os laboratórios já dispõem de métodos adequados para a determinação das isoenzimas da CK.
A CK1 é predominante no cérebro, próstata, intestino, pulmão, bexiga, tireóide, útero e placenta, enquanto que a CK3 predomina nos músculos esqueléticos e cardíaco. A CK2 (CKMB) está presente no músculo cardíaco (25 a 46% da atividade de CK) e nos músculos esqueléticos (5%). As 3 isoenzimas encontram-se no citosol das células ou associadas a estruturas miofibrilares.
Além dessas 3 isoenzimas citosólicas CK-BB (CK1), CK-MB (CK2) e CK-MM (CK3), existem ainda 2 isoformas mitocondriais (CK-Mt) e também 2 isoformas macromoleculares denominadas de Macroquinases
A CK-Mt, de origem mitocondrial, difere das outras imunologicamente e na mobilidade eletroforética. No coração, a CK-Mt corresponde a 15% da atividade da CK Total. As frações macromoleculares são denominadas de macro CK dos tipos 1 e 2, sendo que o tipo 1 é a CK1 associada a IgG, ou CK3 a IgA; e o tipo 2 é a CK-Mt oligomérica.
Por ser encontrada no músculo cardíaco, na musculatura esquelética e no cérebro, um aumento nos níveis séricos de CK pode indicar uma lesão nas células desses orgãos.
Portanto, uma elevação de CK Total pode ocorrer tanto no IAM como em outras patologias. De acordo com a literatura, a CK encontra-se aumentada numa faixa de 65-100% dos pacientes com infarto agudo do miocárdio. No infarto do miocárdio, a CK comporta-se de modo semelhante à AST, porém as doenças hepatocelulares que produzem elevações da AST não exercem nenhum efeito sobre a CK.
Como marcador de IAM, o ideal é a dosagem da fração CK-MB (CK2) pela sua especificidade e sensibilidade.
São várias as metodologias para a dosagem da CK-MB (CK2), destacando-se dentre elas as seguintes:
Imunoinibição
É a metodologia mais empregada para a dosagem da CK-MB (CK2). Consiste na inibição das unidades M com um anticorpo anti M e dosagem posterior da fração B da MB circulante, uma vez que a fração BB predomina no cérebro, sendo contida pelas meninges desde que estejam íntegras.
A solicitação de dosagem de CK Total juntamente com a de CK-MB (CK2) é uma prática recomendável com o objetivo de poder identificar ou suspeitar da presença de frações séricas atípicas. Nesses casos, os valores de CK Total e de CK-MB (CK2) são próximos.
Este fato pode ser minimizado quando se emprega a dosagem de CK-MB (CK2) por Quimioluminescência (MASSA).
Quimioluminescência (MASSA)
Esta metodologia emprega um anticorpo monoclonal específico para a fração MB, não sofrendo a interferência das frações atípicas quando circulantes.
Eletroforese
É uma metodologia bastante sensível e específica, principalmente, quando se usa a eletroforese de alta voltagem (1450 v) que possibilita inclusive o subfracionamento da CKMB em CK-MB1 e CK-MB2, tornando o diagnóstico mais precoce (2 horas após os sintomas). Por ser uma técnica de alto custo, ainda está restrita à pesquisa.
Cromatografia em Coluna
NOVOS MARCADORES
1.TROPONINAS
As troponinas são proteínas presentes nas células musculares do aparelho miofibrilar do sarcômetro, isto é o núcleo básico da parte contrátil da fibra muscular cardíaca.
A troponina T e, em particular a troponina I são marcadores cardioespecíficos da lesão cardíaca. A principal desvantagem é que as alterações no soro não são detectadas nas primeiras horas após o início dos sintomas (de 6 a 18 horas). Esses marcadores surgem em paralelo com a dosagem de massa da CK-MB.
As troponinas são compostas de múltiplas sub-unidades:
Ø Troponina T (TnT) que é uma sub-unidade ligada à miosina (Tropomiosina).
Ø Troponina I (TnI) é uma sub-unidade inibidora de actina (Actinomiosina).
Ø Troponina C (TnC) é a sub-unidade ligada ao cálcio e regula a contração.
Ø Troponinas TnTc e TnIc, formas denominadas cardioespecíficas, diferindo dos seus homônimos da musculatura esquelética pela seqüência de aminoácidos em diversos
locus.
A determinação da TnIc tem sofrido restrições devido à falta de padronização dos anticorpos e também por causa das reações cruzadas que ocorrem com as formas complexadas com a TnC. Há também problemas com a capacidade de fosforilação, oxidação e redução que lhe impõem uma falsa negatividade, bem como uma falsa positividade em pacientes renais crônicos que ocorre também com a TnTc. Esses problemas têm sido minimizados com a determinação da TnTc empregando metodologias com ensaios de 2ª geração.
Como marcador do IAM, as troponinas têm características de:
- Apresentar alta sensibilidade e especificidade na detecção ou exclusão de Infarto do Miocárdio.
- Servir para avaliar o risco em pacientes com Angina de Peito Instável (detecção de Microinfartes)
- Possibilitar o diagnóstico tardio de Infarto do Miocárdio até uma semana após o início da dor.
- Auxiliar na triagem dos pacientes com dores no peito.
- Monitorização não invasiva de terapêutica trombolítica.
- Monitorização de lesão cardíaca durante e após Cirurgia Geral.
2.MIOGLOBINA
É uma hemoproteína de PM 17.600 daltons, localizada no citoplasma celular, que está presente tanto na musculatura esquelética quanto na cardíaca.
É um dos marcadores mais precoces para o diagnóstico do IAM, mas devido à sua inespecificidade tem sido preterida, servindo apenas como diagnóstico de exclusão, ou em casos confirmados de IAM serve para avaliar o sucesso da reperfusão quando se usa terpêutica trombofílica. Quando é determinada junto com a Anidrase Carbônica III, os valores altos de mioglobina podem ser úteis quando se suspeita de IAM.
A mioglobina pode ser detectada no soro dentro de 2 a 5 horas do início do infarto, atinge o pico por volta das 12 horas e cai para dentro do seu intervalo de referência em 24 horas.
Resultados falso positivos surgem em conseqüência de lesão do músculo esquelético, e ocorrem também na insuficiência renal devido a uma incapacidade de excretar esta molécula na urina.
3.MIOSINA DE CADEIA LEVE
É o mais recente marcador para o diagnóstico do IAM, porém ainda não se tem uma avaliação muito acentuada de sua utilidade.
ENZIMAS EM DOENÇAS DA PRÓSTATA
FOSFATASE ÁCIDA
(FOSFATASE ÁCIDA PROSTÁTICA)
Siglas utilizadas: ACP - FAC (Fosfatase ácida) - PAP (Fosfatase ácida prostática)
Nome sistemático (IUB): Fosfohidrolase monoéster ortofosfórica
Nome comum: Fosfatase ácida
pH ótimo: 4,8 a 6,0
A denominação Fosfatase Ácida (FA) compreende um grupo de fosfatases que hidrolisam substratos de ésteres do ácido fosfórico em pH abaixo de 7,0. Estas fosfatases são um grupo de isoenzimas similares ou relacionadas entre si e cada uma não uma espécie particular de enzima.
A fosfatase ácida é encontrada em muitos tecidos como próstata, hemácias, plaquetas, fígado e medula óssea. Como a glândula prostática é responsável pelos níveis mais altos dessa enzima, a principal finalidade de sua determinação laboratorial é auxiliar no diagnóstico de carcinoma da próstata e monitorar a eficácia do respectivo tratamento. Devido à importância do aumento da atividade da FA no diagnóstico e monitorização do câncer da próstata, é importante verificar, nos casos de aumentos pouco significativos, se a elevação é ou não devida à isoenzima prostática.
Valores elevados da enzima são encontrados em pacientes com câncer de próstata com metástase além da cápsula, especialmente nos ossos. Havendo sucesso no tratamento por cirurgia, os níveis de fosfatase ácida decrescem em alguns dias. Quando o tratamento empregado é a estrogenoterapia, os níveis da enzima decairão em algumas semanas.
Quando ocorrer um novo aumento da enzima após a terapia significa um prognóstico ruim para o paciente.
Várias isoenzimas da fosfatase ácida podem ser fracionadas por eletroforese, sendo a isoenzima prostática (Fosfatase Ácida Prostática - PAP) a de maior importância clínica. Para o diagnóstico do câncer de próstata, a determinação da fosfatase ácida prostática (PAP) é mais específica do que a fosfatase ácida total, porém menos específica do que a determinação do antígeno prostático específico (PSA).
Valores Elevados
Valores elevados de fosfatase ácida são mais comumente encontrados nas seguintes patologias: câncer de próstata, manipulação recente da próstata, hipertrofía benigna da próstata, metástases ósseas de câncer não prostático.
Amostra biológica
Sangue. Usar soro ou plasma colhido com heparina. Evitar a hemólise.
A atividade enzimática é sensível ao efeito da temperatura e pH. Portanto, separar o soro ou plasma até 30 minutos após a colheita e acidificar cada 1,0 mL da amostra com 0,01 mL (10µL) de ácido acético 20% (V/V) ou com 0,02 mL (20 µL) de tampão acetato 5M pH 5,0.
A atividade enzimática da amostra acidificada é estável por 2 dias entre 2-8°C e por 1 semana a 10°C negativos.
Fatores interferentes
Devido à estimulação prostática, os valores de fosfatase ácida podem estar elevados em pacientes após o exame de toque retal ou após instrumentação da próstata (citoscopia).
As drogas que podem elevar os níveis da fosfatase ácida são: clofibrato (Atromid S) e andrógenos em mulheres.
As drogas que podem provocar uma diminuição da fosfatase ácida são: fluoretos, fosfatos, oxalatos e álcool.
Métodos de Dosagem
Vários são os métodos que podem ser empregados para a dosagem da fosfatase ácida, sendo que aqueles utilizando a timolftaleína monofosfato como substrato apresentam uma boa especificidade para a isoenzima prostática.
Vários inibidores das isoenzimas têm sido utilizados na dosagem da isoenzima prostática (PAP), sendo que o tartarato é o mais comumente usado porque inibe praticamente toda a atividade enzimática da fração prostática. Os íons cobre e o formaldeído têm sido utilizados para inibir as fosfatase ácidas não prostáticas, principalmente a hemática. Do ponto de vista prático pode-se prevenir a interferência da enzima da hemácia realizando uma colheita da amostra em condições técnicas adequadas para prevenir a hemólise, providenciando a separação imediata, com acidificação e refrigeração do soro para estabilizar a atividade enzimática.
Os inibidores aumentam o trabalho operacional porque requerem, para cada amostra, dois ensaios da atividade enzimática sendo um deles com a presença do inibidor. Uma alternativa é a utilização de substratos mais sensíveis à atividade da isoenzima prostática como ocorre com o a naftil fosfato e a timolftaleína monofosfato. Do ponto de vista prático estes substratos não são hidrolisados pelas isoenzimas eritrocitárias e plaquetárias, porque somente uma fração muito pequena e desprezível da atividade encontrada será devida às fosfatases de origem hemática ou plaquetária.
1. Metodologia Cinética Colorimétrica de Tempo Fixo (Roy mod.)
O produto utiliza um substrato de timolftaleina monofosfato que, apesar do sistema medir a fosfatase ácida total, os resultados quando elevados, podem ser considerados como sendo correspondentes à fração prostática, porque a sensibilidade do substrato às outras frações é consideravelmente diminuída e os valores encontrados para a atividade das fosfatases não prostáticas são tão reduzidos que não têm significado clínico.
Fundamento Químico
A fosfatase ácida hidrolisa o substrato de timolftaleína monofosfato, liberando timolftaleína e fosfato inorgânico. Pela adição de álcali, a ação enzimática é inibida e a timolftaleína é convertida na sua forma azul, cuja absorbância é medida fotometricamente. O produto final da reação se constitui de uma mistura de cor azul e a cor própria do substrato.
Valores de Referência
Soro ou plasma: 0,15 a 0,56 U/L.
2. Metodologia Cinética Colorimétrica para dosagem da Fosfatase Ácida Total e
Prostática (FAC TOTAL e PROSTÁTICA)
Fundamento Químico
A fosfatase ácida (FAC) catalisa em meio ácido a hidrólise do -naftilfosfato. O α–naftol produzido reage com um sal de diazônio (Fast Red TR) formando um cromógeno. A atividade catalítica é determinada a partir da velocidade de formação do referido cromógeno medido em 405 nm. O tartarato é usado no método como inibidor específico da fração prostática da fosfatase ácida. A fosfatase ácida prostática é calculada pela diferença entre a fosfatase ácida total e a fração inibida pelo ácido tartárico (não prostática).
Valores de Referência
Fosfatase ácida total até 10 U/L
Fosfatase ácida prostática: até 3,5 U/L
ANTÍGENO PROSTÁTICO ESPECÍFICO
Sigla utilizada: PSA = Prostate-specific antigen
Nome oficial: Semenogelase
Nomes alternativos: gama-seminoproteína, seminina e antígeno p30.
O antígeno prostático específico (PSA), isolado e identificado por Wang e cols.em 1979, é uma glicoproteína monomérica com peso molecular de 34.000, produzido somente pelo tecido prostático seja normal, hiperplasiado ou maligno.
Em termos de g%, o tecido prostático canceroso produz cerca de 10 vezes mais PSA do que o tecido normal.
O PSA é secretado no líquido seminal, tem uma atividade similar à da tripsina e quimiotripsina, com a função de liquefazer o coágulo.
Por ser produzido exclusivamente pela próstata, há uma tendência de valorização da dosagem do PSA como um marcador de Adenocarcinoma Prostático (ACP).
O PSA é considerado um ótimo marcador tumoral na triagem do câncer de próstata, mas no início, seu uso servia apenas para indicar a massa tumoral e progressão da doença.
Em vários estudos tem-se verificado que a associação de um PSA monoclonal maior que 4,0 ng/mL com um toque retal anormal é um método altamente sensível e específico na detecção do câncer de próstata.
Como não é encontrado em nenhum outro tecido, o PSA estará elevado na hipertrofia benigna da próstata (HPB), no adenocarcinoma de próstata (ACP), na prostatite aguda ou crônica, no infarto de próstata e após o manuseio prostático.
Assim sendo, a determinação dos níveis séricos de PSA no laboratório clínico vem se constituindo no mais significativo avanço para o diagnóstico e acompanhamento do adenocarcinoma prostático (ACP).
Em síntese, a dosagem do PSA no soro tem sido empregada:
1. Como um eficiente marcador tumoral do adenocarcinoma prostático (ACP).
2. Para monitorar a terapêutica de pacientes portadores de neoplasia prostática. Se após uma prostatectomia radical constatar-se PSA no soro, indica presença de resíduos de tecido prostático ou metástases. Consequentemente, aumentos gradativos dos níveis séricos de PSA revelam a recorrência da doença.
3. Em programas de screening de ACP em populações selecionadas de homens, assintomáticos e com idade superior a 50 anos, permitindo o diagnóstico precoce, a nível populacional.
Entretanto, o simples aumento na taxa de PSA Total sérico não permite uma conclusão diagnóstica, visto que, além do ACP, outras patologias benígnas da próstata como a hiperplasia benigna da próstata (HBP) e prostatite podem elevar o PSA Total.
Mais recentemente foi demonstrado que o PSA encontra-se no soro nas seguintes formas:
1. 10% na forma livre.
2. de 90% ligado a inibidores de protease tais como a alfa1-antiquimiotripsina (ACT-PSA).
3. O PSA Total representa a somatória das duas formas 1 e 2.
A meia vida do PSA complexado é de cerca de 2 a 3 dias, sendo que esta lenta eliminação se deve ao fato da molécula ser grande e de difícil filtração glomerular. Já a fração livre tem uma meia vida de cerca de 2 horas, pois é compatível com a filtração glomerular.
Com os avanços metodológicos recentes, constatou-se que os pacientes com patologias prostáticas benígnas (HBP e prostatite) apresentam uma proporção maior da forma livre do PSA em relação ao PSA Total, enquanto que em pacientes com ACP há maiores proporções da forma complexada do PSA.
Com base nesse conhecimento, vários estudos demonstraram que os portadores de ACP apresentam uma relação PSA Livre/PSA Total inferior a 20%, enquanto que nos pacientes com HBP essa relação é igual ou superior a 20%.
Amostra biológica
Sangue. Usar soro. Evitar a hemólise.
Evitar manipulação prostática 48 horas antes do exame. Jejum de 8 horas.
Métodos de Dosagem
Enzima Imunoensaio (EIA)
Ensaio Imunoradiométrico (IRMA)
Ensaio Imunofluorimétrico (IFMA)
Metodologia Imunofluorimétrica
Os valores de referência variam de acordo com a metodologia empregada.
Método Fluorimétrico Duplo:
PSA Total: até 5,20 ng/mL
PSA Livre: até 0,88 ng/mL
Relação Percentual: abaixo de 20% provável ACP
Acima de 20% provável HBP
Atenção: A relação percentual só é válida quando o valor de PSA Total for acima de 4,0
ng/mL
BIBLIOGRAFIA
1. Adolph L. Diagnóstico enzimático das doenças do coração, fígado e pâncreas. Basiléia, S.
Karger, 1980
2. Analisa Diagnóstica - Manual de Produtos e Técnicas.
3. Baptista JMA. Enzimologia Clínica. Belo Horizonte, Departamento de Análises Clínicas e
Toxicológicas da Faculdade de Farmácia da UFMG, 1996
4. Burtis CA, Ashwood ER. Tietz Textbook of Clinical Chemistry. 2a edição, Philadelphia, W.
B. Saunders Company, 1994
5. Cardoso ICRA, Benfica MGA, Chamone CB, Castro GFC, Peixoto KB: Utilização do
antígeno prostático específico (PSA livre e total), como marcador tumoral no diagnóstico
de câncer de próstata e hiperplasia benígna prostática. Rev. Bras. Anal. Clin. 32(1) 3-6,
2000.
6. Dio RD, Barbério JC, Pradal MG, Menezes AMS: Antígeno Prostático Específico, PSA:
Recentes Avanços Clínicos e Metodológicos. Rev. Bras. Anal. Clin. 27(4) 137-138, 1998.
7. Henry JB. Diagnósticos Clínicos & Tratamento por Métodos Laboratoriais. 18a. edição,
São Paulo, Editora Manole Ltda, 1995.
8. Jacobs DS, DeMott WR, Grady HJ, Horvat RT, Huestis DW, Kasten Jr BL. Laboratory Test
Handbook. 4a ed. Hudson (Cleveland), Lexi-Comp Inc, 1996
9. Kaplan A, Szabo LL, Opheim KE. Clinical Chemistry: Interpretation and Techniques.
Philadelphia, Lea & Febiger, 1988
10.Labtest Diagnóstica - Manual de Produtos e Serviços.
11.Lima JCC, Moreira A, Sodré FL: Uma nova Abordagem Bioquímica no Diagnóstico das
Síndromes Coronarianas Agudas (Infarto Agudo do Miocárdio) Newslab edição 33: 142-
152, 1999.
12.Lopes HJJ. Enzimas no Laboratório Clínico-Aplicações Diagnósticas 1ª edição
Belo
Horizonte, Analisa Diagnóstica LTDA.
13.Mercatelli C, Picciarelli FB, Laudari H, Amoedo TV: Troponina I: o marcador mais
específico para diagnóstico do IAM. LAES & HAES108, 174-180, 1997
14.Nogueira DM, Strufaldi B, Hirata MH, et al. Métodos de Bioquímica Clínica: Técnica e
Interpretação. São Paulo: Pancast Editora, 1990
15.Pagana KD, Pagana TJ. Mosby s - Diagnostic and Laboratory Test Reference 3a ed.
Philadelphia, Mosby, 1997
16.Ravel R. Laboratório Clínico: Aplicações Clínicas dos dados Laboratoriais. 6a edição, Rio
de Janeiro, Editora Guanabara Koogan, 1997
17.Roy AV, Brower ME, Hayden JE. Clin Chem 1971;17:1093-1101.
18.Wu AHB. Troponina Cardíaca: Marcador de Lesão do Miocárdio para o próximo milênio.
LAES & HAES 240-244, 1999


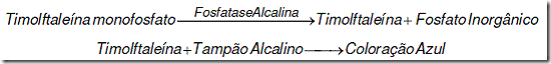





Nenhum comentário:
Postar um comentário
► NÃO faça comentários ofensivos
► Faça comentários apenas RELATIVOS ao assunto do artigo
► NÃO faça conversas irrelevantes nos comentários, isso não é um chat
► É PROIBIDO usar links desnecessários, para isso comente usando OpenID
► Os comentários são VERIFICADOS, para garantir que não seja violada as regras acima
Se preferir, fale conosco link de CONTATO.