INTRODUÇÃO
A doença arterial coronariana (DAC) constitui uma das causas mais importantes de morbidade e mortalidade no Brasil e em todo o mundo e atinge, principalmente, indivíduos em idade de alta produtividade, gerando perdas econômicas significativas. Muitos países têm adotado ambiciosos programas destinados a reduzir a incidência de DAC, através de projetos de educação de adultos, para que tenham conhecimento dos fatores de risco mais importantes e das formas de prevenção, incluindo modelos de alimentação sadia e preventiva.
No Brasil várias sociedades médicas, lideradas pela Sociedade Brasileira de Cardiologia, iniciaram um trabalho para a definição de um consenso sobre as Dislipidemias, tendo publicado recentemente o IV Consenso Brasileiro sobre Dislipidemias, onde abordam os lípides, lipoproteínas e suas relações com a aterogênese. Tratam ainda das dislipidemias, seu diagnóstico e suas associações com a aterogênese, discutindo ainda as formas atuais de tratamento das dislipidemias.
O enfoque do IV Consenso Brasileiro sobre Dislipidemias, é, e não poderia ser de outra forma, clínico, pois a publicação tem como alvo os cardiologistas e outros médicos interessados no tema da DAC.
Nossa proposta neste post, Revisitando os Lípides as Lipoproteínas, é apresentar um enfoque mais dirigido ao Laboratório Clínico, com discussão das metodologias utilizadas para medir os lípides que apresentam maior importância em sua relação com a DAC. O objetivo é também mostrar as causas de variabilidade nos resultados dos lípides, e indicar os fatores responsáveis pelos erros aleatórios e sistemáticos.
Trata-se de um trabalho de revisão, onde procuramos enfatizar a necessidade de que os laboratórios se esforcem na busca do aperfeiçoamento do desempenho, para que possam oferecer maior confiabilidade nos resultados e também para que os resultados possam classificar os pacientes, distinguindo o grupo de risco o mais corretamente possível.
Apresentamos também um apêndice mostrando a distribuição dos resultados do colesterol total, colesterol HDL e triglicérides em três capitais brasileiras e damos orientações para avaliar o desempenho dos ensaios no laboratório.
OS LIPIDES
PARTE I:
A importância dos lípides em Medicina já era conhecida muito antes da disponibilidade dos ensaios para medir isoladamente cada um dos lípides. O conjunto dos lípides plasmáticos é constituído por várias substâncias com estruturas moleculares diferentes, que têm uma característica em comum, serem insolúveis ou praticamente insolúveis em solventes polares como a água, que é o principal componente do plasma.
O conteúdo total dos lípides séricos pode ser determinado pela extração de todos os lípides em um solvente orgânico e o resultado é reportado em peso do material extratável em relação a um volume da amostra. Neste ensaio, o colesterol total, os triglicérides, os fosfolípides e os ácidos graxos livres são reportados como um único valor. Na presente data existem métodos disponíveis para medir cada um dos lípides isoladamente, e a dosagem dos lípides totais não tem utilidade diagnóstica.
Colesterol
O colest-5-en-3b-ol (colesterol) pertence a uma classe de 3b-hidroxi esteróides que tem a mesma estrutura básica. Misturas de esteróides 3b-hidroxi podem ser isoladas de plantas, peixes e outras formas de vida, mas o colesterol é o principal esteróide das formas superiores de vida. Nos seres humanos o colesterol está presente em todos os tecidos corporais e a maioria das células, com exceção das hemácias, é capaz de sintetizar o colesterol.
O colesterol isolado de amostras biológicas pode ser encontrado na forma de um álcool, colesterol livre e na forma esterificada por um ácido graxo de cadeia longa, o colesterol esterificado. As amostras de plasma ou soro contêm uma percentagem maior de colesterol esterificado (75 a 85%).
O colesterol total em humanos está distribuído entre as três maiores classes de lipoproteínas: HDL, LDL e VLDL. Quantidades menores estão presentes nas lipoproteínas de densidade intermediária (IDL) e na Lipoproteína (a), sendo que estas duas lipoproteínas contêm aproximadamente 2-4 mg/dl.
Do ponto de vista fisiológico, o colesterol tem duas funções. É um dos maiores constituintes das membranas celulares e atua como um componente estrutural em todas as células. Em outra função importante, o colesterol atua como um molécula precursora de outros esteróides. Pequenas quantidades de colesterol são necessárias para a síntese de outros esteróides biologicamente ativos, como os hormônios sexuais femininos e masculinos (estrógenos e andrógenos) e os corticosteróides adrenais (aldosterona e corticosterona).
Além disto, aproximadamente 0,5 grama de colesterol é convertido diariamente em ácidos biliares que atuam como detergentes no trato gastrointestinal, para solubilizar e promover a digestão e absorção das gorduras da dieta.
Ao contrário dos triglicérides e fosfolípides, não existem enzimas capazes de metabolizar o colesterol que não tem ação como fonte de energia para as células humanas.
Variação pré-analítica e Preparo do Paciente
A obtenção da amostra de sangue e o preparo do paciente devem ser padronizados para minimizar o impacto da variabilidade pré-analítica na determinação do colesterol. As maiores causas de variabilidade pré analítica incluem a postura do paciente e o uso do garrote durante a colheita de sangue. A postura durante a colheita da amostra deve ser padronizada, porque pode ter efeitos significativos nos resultados. Se as amostras são obtidas na posição sentada, deve-se padronizar para que o indivíduo esteja sentado durante 15 minutos e não mais que 30 minutos. Um garroteamento maior que 1 minuto produz hemoconcentração, que pode aumentar os valores do colesterol em 5% após 2 minutos e 10 a 15% após 5 minutos. Portanto, é muito importante que os laboratórios padronizem o procedimento da colheita da amostra.
A necessidade do jejum para a determinação do colesterol total é bastante controvertida, principalmente porque o colesterol absorvido da alimentação permanece somente pouco tempo na circulação. De modo geral, a amostra de sangue pode ser obtida com ou sem jejum, mas é altamente recomendável que todos os ensaios dos lípides sanguíneos, incluindo o colesterol, sejam realizados em amostras colhidas em jejum. As vantagens da utilização de amostras colhidas em jejum são decorrentes da padronização da colheita, pois permitem a realização da determinação de outros lípides que requerem o jejum e eliminam a interferência da lipemia pós prandial, que está frequentemente presente em amostras obtidas sem o jejum. Tipicamente, um jejum de 12 horas não deve incluir, antes da colheita, a ingestão de alimentos, creme, açucar, e álcool. O café sem açucar ou creme não produz interferência significativa nos valores do colesterol. Restrição total de água e medicamentos
durante o período de jejum é desnecessária na maioria dos casos, podendo mesmo ser contra-indicada em muitos pacientes. O jejum não tem efeito significativo nos levantamentos epidemiológicos para avaliação da hipercolesterolemia em indivíduos sadios.
A variação biológica do colesterol, decorrente da variação também biológica das lipoproteínas transportadoras do colesterol, é observada quando a dosagem do colesterol é repetida em um mesmo laboratório no espaço mínimo de uma semana. Ela ocorre independentemente do erro analítico e pode variar entre 6 e 11% com uma média de 8,2%, consequente, principalmente, à variação biológica da LDL, que é a principal lipoproteína transportadora de colesterol.
Considerações sobre a amostra
A maioria das determinações do colesterol é realizada em amostras de sangue venoso. Entretanto, amostras de sangue capilar são utilizadas em levantamentos epidemiológicos e os valores do colesterol assim obtidos não são representativos de uma amostra venosa. Tem sido reportado que os valores dos lípides e lipoproteínas, encontrados em amostras capilares, são aproximadamente 9% menores que em sangue venoso. Como os valores diminuídos obtidos em sangue capilar podem ser devidos a diluições das amostras pela linfa ou líquido intersticial, as amostras capilares devem ser colhidas sob condições bem rigorosas de padronização, para eliminar ou minimizar as diluições.
Pode-se usar amostras de soro ou plasma, mas os resultados costumam ser diferentes, pois os valores obtidos em plasma podem ser menores devido a fatores como anticoagulantes que iniciam a liberação de líquido intracelular, promovendo a diluição. O manuseio incorreto da amostra pode também promover a peroxidação dos lípides, lipólise e a troca de lípides e apoproteínas entre as lipoproteínas. A amostra de plasma ou soro deve ser separada dentro de 3 horas da colheita do sangue e armazenada até 3 dias a 4° C ou várias semanas a 20° C negativos. Em todos os casos, as amostras devem ser armazenadas em recipientes bem vedados que previnam a evaporação, evitando-se utilizar tampas de cortiça ou filmes plásticos.
Os métodos enzimáticos utilizam o soro em mistura direta com o reagente e valores elevados da hemoglobina, bilirrubina e triglicérides podem produzir interferências espectrais significativas. Resultados obtidos em nossos laboratórios demonstram que ocorrem interferências positivas da hemoglobina e dos triglicérides, quando os valores são maiores que 180 mg/dl e 250 mg/dl, respectivamente. A interferência da hemoglobina pode ser corrigida com a utilização de brancos da amostra que reduz as interferências a valores pouco significativos. A bilirrubina elevada, além da interferência espectral, também produz interferência negativa na reação catalisada pela peroxidase. Esta interferência pode ser minimizada por ação da bilirrubina oxidase ou do ferrocianeto de potássio. Para correção da interferência espectral na dosagem enzimática do colesterol produzida pela lipemia, os reagentes devem conter substâncias clarificadoras que são enzimas ou detergentes, que eliminam ou minimizam significativamente a interferência.
Níveis elevados de ascorbato (vitamina C) produzem interferências negativas por competição com o cromogênio na reação da peroxidase. Esta interferência pode ser
eliminada mantendo-se o soro na temperatura ambiente por um mínimo de 2 horas antes de usá-lo no ensaio ou utilizando um reagente contendo ascorbato oxidase.
Metodologias de Ensaio
Até meados dos anos 70, o colesterol era medido rotineiramente usando reagentes cáustico tais como, ácido sulfúrico concentrado, anidrido acético e ácido acético. Neste ensaio, o colesterol e os ésteres do colesterol formam produtos ionizados com absorbância entre 560 e 620 nm e que são medidos fotometricamente. O método de Abell, Levy, Brodie e Kendall, denominado método de Abell-Kendall e modificado pelo Centers for Disease Control (Estados Unidos), ainda é considerado como o método de referência nacional nos Estados Unidos.
Nos últimos 10 a 15 anos, um grande número de laboratórios passaram a utilizar os métodos enzimáticos, que ganharam rápida aceitação devido ao pequeno volume da
amostra, facilidades para automação e ausência de reagentes cáusticos. Os custos totais para realização dos métodos químicos e enzimáticos são praticamente equivalentes.
PARTE II:
Métodos Químicos
Os métodos baseados em meio ácido ou utilizando íons férrico estão sendo praticamente eliminados da rotina dos laboratórios clínicos porque a maioria destes ensaios requer procedimentos de extração ou pré-tratamento da amostra e utilizam reagentes cáusticos, fazendo com que não sejam aplicáveis em sistemas automáticos de análise. Entretanto, o método de Abell Kendall modificado permanece ainda em uso, sendo usado como método de referência por muitos laboratórios ou grupos profissionais, dentre eles o CDC.
No método de Abell Kendall, o colesterol livre e os ésteres de colesterol são extraídos com uma mistura de clorofórmio/metanol ou com isopropanol. Os ésteres do colesterol são então hidrolisados a colesterol livre com potassa alcoólica. Uma alíquota do extrato orgânico após secagem e contendo colesterol livre é colocada para reagir com uma mistura de ácido acético, anidrido acético e ácido sulfúrico, produzindo um cromogênio que tem absorção máxima em 620 nm. O método é calibrado diretamente com um padrão de colesterol livre dissolvido em um solvente orgânico. Um técnico suficientemente treinado pode processar 50 a 60 amostras por dia, enquanto que usando uma metodologia enzimática em um sistema automático pode-se dosar centenas de amostras por dia. O método de Abell Kendall tem sido comumente utilizado para estabelecer valores de referência em amostras de soro e transferir exatidão para soros liofilizados ou soros frescos congelados. No Brasil ainda se encontra metodologias manuais de baixo custo, utilizando um reagente composto de uma mistura de ácido acético, anidrido acético e ácido sulfúrico (reação de Liebermann Burchard), que reage diretamente com a amostra de soro, não submetida a qualquer tratamento prévio. Os resultados do PNCQ da Sociedade Brasileira de Análises Clínicas, que utiliza amostras de soro humano em seu programa de Controle da Qualidade, indicam que estes métodos químicos diretos produzem valores até 30% mais elevados, devido à interferência da matriz, isto é, o meio físico-químico onde o colesterol está disperso. Evidentemente, esta interferência tão significativa compromete de modo importante a interpretação dos resultados e dificulta a correta avaliação do significado do fator de risco mais importante para a doença aterogênica. Também, nestes métodos químicos diretos, as interferências da bilirrubina elevada, da hemólise e da lipemia são muito mais significativas e não existe um processo corretivo eficiente para minimizar a ação destes interferentes, a não ser que se utilize procedimentos de extração com solventes orgânicos.
Métodos Enzimáticos
Pode-se admitir que os métodos para colesterol utilizando enzimas como reagentes estão sendo universalmente aceitos como métodos de rotina nos laboratórios clínicos e as enzimas colesterol esterase e colesterol oxidase são os reagentes mais comuns na maioria dos produtos comerciais. Nestes procedimentos a colesterol esterase hidrolisa o colesterol esterificado a colesterol e ácidos graxos livres. O colesterol livre é oxidado pela colesterol oxidase, na presença de oxigênio, para formar coleste-4-ena-3-ona e peróxido de hidrogênio.
Os métodos para quantificação do colesterol utilizam tanto o consumo de oxigênio, quanto a formação do peróxido de hidrogênio como indicadores da quantidade de colesterol presente na amostra. A maioria dos produtos comerciais mede a quantidade de peróxido através de uma segunda reação enzimática, como a reação de Trinder, catalisada pela peroxidase, utilizando a copulação oxidativa da 4-aminoantipirina e fenol com formação do cromóforo quinoneimina e água. O cromóforo tem absorção máxima em torno de 500 nm e pode ser medido fotometricamente.
Vários derivados do fenol e da anilina têm sido utilizados como substitutos do fenol, com a finalidade de aumentar a sensibilidade da reação por aumento da absortividade do cromóforo. Existe também uma tendência para utilizar um substituto do fenol, capaz de produzir um cromóforo com absorção máxima no infravermelho, onde as interferências da hemólise, bilirrubina elevada e lipemia são minimizadas. A utilização da potencialidade do infravermelho ainda é reduzida devido à pequena disponibilidade de equipamentos capazes de fazer medições confiáveis na região do infravermelho.
Outros métodos de ensaio para o colesterol incluem a cromatografia gasosa e a cromatografia líquida de alto desempenho, que são usados principalmente como métodos de pesquisa.
Um método definitivo denominado Diluição Isotópica foi estabelecido para a dosagem do colesterol e utiliza a cromatografia de gás em associação com a espectrometria de massa. O National Institute of Standards and Technology (NIST-USA) utiliza este método de ensaio para determinar valores assinalados para materiais de referência. Os métodos definitivos são muito trabalhosos e de custo elevado, não sendo adequados para uso na rotina dos laboratórios.
Padronização e Requerimentos de Desempenho
O programa Nacional de Educação em Colesterol dos Estados Unidos (NCEP), criado pelo "National Institutes of Health", tem procurado promover o aperfeiçoamento dos ensaios para colesterol nos laboratórios clínicos e estabeleceu as metas de desempenho para todos os laboratórios. O NCEP trabalha com um grupo de padronização em laboratório, composto de especialistas na área de lípides e lipoproteínas, incluindo representantes de agências governamentais, organizações profissionais e pessoal de laboratório. As metas correntes estabelecem que os métodos devem ter a imprecisão e o bias iguais ou menores que 3% (tabela 1) e o desempenho obtido pelo laboratório deve ser documentado.
A grande vantagem da utilização deste modelo é que uma inexatidão maior que 3% pode ser tolerada quando o procedimento é muito preciso. Por outro lado, as imprecisões mais significativas podem ser aceitas se os ensaios são mais exatos. As vantagens do emprego do erro total podem ser melhor compreendidas com o exemplo mostrado no apêndice A Quando um método demonstra ter o desempenho exigido pelo NCEP, deve ser implementado um programa de monitorização para assegurar a manutenção do desempenho. O programa de controle da qualidade deve considerar a origem dos reagentes, o número de controles e a frequência dos ensaios. Os materiais utilizados podem ser liofilizados ou congelados. Entretanto, tem sido observado que os materiais liofilizados utilizados nas dosagens de colesterol, triglicérides e lipoproteínas apresentam significativos efeitos de matriz, podendo não ser adequados para calibração e muitas vezes não são suficientemente adequados para transferir exatidão ao sistema metodológico. O Colégio de Patologistas Americanos (CAP) e o Comitê Nacional de Padrões em Laboratórios Clínicos(NCCLS) estão desenvolvendo programas paralelos para a produção de soros frescos congelados e determinação de valores definitivos para colesterol nestes soros. Este programa, devido ao seu elevado custo, só estará disponível a um número restrito de laboratórios clínicos e fabricantes americanos e provavelmente não estará acessível a laboratórios brasileiros.
Os materiais de controle devem ser selecionados para incluir concentrações nos níveis críticos de decisão para colesterol, tais como 150, 200 e 240 mg/dl. O desempenho em concentrações de 300 mg/dl ou em concentrações mais elevadas é menos crítico que em menores concentrações.
O NIST tem disponível o 1o. Material de Referência de Colesterol puro, SRM 91b. O 2o. material de referência está disponível no NIST, SRM 909 e no CDC na forma de soros congelados.
Interpretação dos Resultados
A concentração do colesterol em indivíduos sadios varia com a idade e o sexo. O estabelecimento de valores de referência locais requer um estudo extensivo para contemplar todas as variáveis envolvidas. Pode-se usar um método alternativo obtendo-se valores publicados na literatura. O NCEP estabeleceu normas para interpretação dos valores dos lípides e lipoproteínas e sugerimos que os laboratórios procurem reportar os valores do colesterol em um formato que mais se aproxime da proposta do NCEP (tabela 2).

O formato do relatório proposto pelo NCEP proporciona um modelo de interpretação mais útil que os sistemas tradicionais, porque coloca os valores do colesterol em 3 faixas que definem claramente o estado de risco individual. O risco estabelecido no modelo do NCEP está baseado em estudos epidemiológicos e não significa que um indivíduo classificado na faixa de alto risco tenha 100 % de probabilidade de apresentar doença aterogênica. Do mesmo modo, um indivíduo colocado na faixa desejável não está totalmente protegido contra a doença aterogênica. Enfatizamos que as faixas de risco devem ser consideradas em termos de probabilidade, onde a frequência da doença aterogênica cresce em função diretamente proporcional à concentração do colesterol.
Os valores do colesterol podem ser relatados no sistema convencional (mg/dl) ou no sistema internacional de unidades (mmol/l). Para converter concentrações obtidas em unidades convencionais, para unidades SI, multiplicar o valor em mg/dl por 0,026. Portanto, um resultado de 200 mg/dl é igual a 5,20 mmol/l.
PARTE III:
Triglicérides
Os triglicérides são formados por uma molécula de glicerol esterificada por três ácidos graxos de cadeia longa. Os triglicérides constituem o maior componente dos glicérides do sangue circulante e dos tecidos. Pequenas quantidades de mono e diglicérides são também presentes e contêm um ou dois ácidos graxos, respectivamente. Os triglicérides constituem a forma primária de armazenamento de energia de longa duração. O metabolismo de 1 grama dos triglicérides produz 9 kcal de energia, enquanto 1 grama de carboidratos produz 4 kcal. Grandes quantidades de triglicérides são armazenadas no tecido adiposo na forma de gotículas de gordura concentrada.
Variação pré-analítica e Preparo do Paciente
No estado de jejum, os quilomicrons estão ausentes em indivíduos que não apresentam defeitos na síntese ou no catabolismo das lipoproteínas ricas em triglicérides. Na ausência do jejum, as concentrações dos triglicérides variam consideravelmente e seus valores se elevam rapidamente após a ingestão de alimentos ricos em gorduras, chegando a um pico máximo após 4 horas da alimentação. Os triglicérides permanecem elevados até 8 horas ou mais, até que os quilomicrons sejam removidos da circulação.
Um grande número de alimentos eleva acentuadamente as concentrações dos triglicérides plasmáticos, tanto que um jejum de 12 horas é recomendado para assegurar que a obtenção da amostra é realizada de um modo padronizado, devendo-se evitar, além de alimentos sólidos, todos os líquidos, à exceção da água. Deve-se padronizar a metodologia para se obter a amostra pela manhã, mas o laboratório deve tentar tornar o horário da colheita o mais conveniente para o cliente. Quando não for possível obter a amostra após jejum de 12 horas, esta mudança no protocolo deve ser anotada nos registros do paciente e no relatório dos resultados.
Na ausência do jejum o coeficiente de variação dos triglicérides varia consideravelmente entre os indivíduos, com uma variação diurna de 6-65%, uma variação mensal de 12,9 - 34,8% e uma variação anual de 12,9-39,9%. Estas variações ocorrem em indivíduos sadios em dietas estáveis, mas variações maiores podem ocorrer em certos estados fisiológicos ou de doença.
A falta de padronização nas colheitas das amostras para a dosagem dos triglicérides tem gerado enormes conflitos entre pacientes, médicos clínicos e os laboratórios porque, em muitos casos, não se toma o cuidado de enfatizar aos pacientes a necessidade do jejum de 12 - 14 horas antes da colheita da amostra. O Laboratório Frischmann-Aisengart, Curitiba, após enfatizar a importância do jejum de 12-14 horas, repetiu as dosagens dos triglicérides naqueles pacientes que apresentaram valores maiores que 400 mg/dl. Os resultados encontrados demonstram que os cuidados de jejum não são observados por um grande número de pacientes ou seus médicos não procuram recomendar o preparo adequado. Os resultados mais expressivos obtidos pelo laboratório são mostrados na tabela 3.

Como a concentração dos triglicérides é influenciada por hábitos dietéticos recentes, consumo de álcool, variações do peso corporal e exercício físico, os valores dostriglicérides em um mesmo indivíduo são bastante variáveis. Usando um método com um CV analítico de 3%, os dados obtidos dentro de um mês mostraram que a variância biológica pode chegar a valores maiores que 90% da variância intraindividual total. Mesmo nos estados de jejum, ocorre considerável variação biológica no mesmo indivíduo. Em pacientes cuidadosamente monitorizados na dieta "Step I" do NCEP ou mesmo em dieta mais restrita, nos quais os triglicérides foram medidos com intervalos de 2 semanas, a diferença percentual nas concentrações das duas amostras foi 5 vezes maior que a variação do colesterol e as diferenças entre os resultados foi maior que 10% em um número superior a 75% dos indivíduos. Um estudo realizado em 7055 indivíduos em jejum, com dosagens dos triglicérides em intervalos médios de 2,5 meses, mostrou uma variação média em torno de 25%.
A ingestão de álcool antes da colheita da amostra pode produzir elevação temporária dos triglicérides. Quando a ingestão de álcool ultrapassa 80 g/dia, ocorre um estímulo da síntese das VLDL, com ativação concomitante da lipase da lipoproteina, que hidrolisa a VLDLTriglicérides, resultando em valores aparentemente normais das VLDL plasmáticas, mesmo quando a síntese das VLDL está aumentada. Nos casos de ingestão de álcool a curto prazo por indivíduos que não têm o hábito de consumir álcool, ocorre aumento dos triglicérides e elevação das VLDL.
Deve-se obter a amostra com o paciente assentado e o torniquete não deve ser mantido por tempo maior que 1 minuto.
Considerações sobre a amostra
Os triglicérides devem ser medidos em indivíduos apresentando um estado metabólico estável. O manuseio incorreto da amostra pode também promover a peroxidação os lípides, lipólise e a troca de lípides e apoproteínas entre as lipoproteínas. A utilização de plasma com EDTA pode prevenir estas modificações químicas por quelação dos cátions divalentes.
A maioria das determinações dos triglicérides é realizada em amostras de sangue venoso e os triglicérides podem ser medidos no soro ou plasma, mas os valores medidos no plasma devem ser relatados como equivalentes aos medidos no soro. Para converter o resultado obtido em plasma com EDTA para os valores séricos, multiplicar o resultado do plasma por 1,03. Quando os triglicérides são medidos no plasma heparinizado, obtém-se resultados equivalentes aos valores do soro.
A amostra de plasma ou soro deve ser separada dentro de 3 horas da colheita do sangue e pode ser armazenada até 3 dias a 4 ° C e várias semanas a 20 ° C egativos. Em todos os casos, as amostras devem ser armazenadas em recipientes bem vedados que previnam a evaporação, evitando-se utilizar tampas de cortiça ou filmes plásticos. Os métodos enzimáticos utilizam uma mistura direta da amostra com o reagente e valores elevados da hemoglobina e da bilirrubina podem produzir interferências espectrais significativas. Resultados obtidos em nossos laboratórios demonstram que ocorrem interferências positivas da hemoglobina e da bilirrubina quando os valores são maiores que 160 mg/dl e 4 mg/dl, respectivamente. Para valores de hemoglobina até 320 mg/dl, a utilização de brancos da amostra, pode minimizar as interferências a valores pouco significativos.
A bilirrubina elevada, além da interferência espectral, também produz interferência negativa na reação catalisada pela peroxidase. Esta interferência pode ser minimizada por ação da bilirrubina oxidase ou do ferrocianeto de potássio. Níveis elevados de ascorbato (vitamina C) produzem interferências negativas por
competição com o cromogênio na reação da peroxidase. Esta interferência pode ser eliminada, mantendo-se o plasma ou soro na temperatura ambiente por um mínimo de 2 horas antes usá-lo no ensaio ou utilizando um reagente contendo ascorbato oxidase.
PARTE IV:
Métodos Químicos
Nestes métodos, o primeiro passo utiliza uma extração dos triglicérides em um solvente orgânico, seguindo-se a remoção dos fosfolípides e outros interferentes por adsorção do extrato com um material insolúvel (reagente de Lloyd, zeolite, terra de diatomáceas ácido silício, alumina ou florizil). Outro procedimento utiliza uma mistura de solventes em meio ácido, onde os triglicérides são extraídos no solvente apolar, enquanto os fosfolípides e outros interferentes permanecem nos solventes mais polares. Os triglicérides são então hidrolisados por saponificação alcalina, produzindo glicerol e, por adição de periodato, o glicerol é oxidado a formaldeído. Neste ponto pode-se utilizar 3 métodos para a formação do cromóforo: a) reação com fenilhidrazina e ferricianeto para produzir um formazan vermelho; b) condensação com ácido cromotrópico em presença de ácido sulfúrico; c) condensação com acetil acetona e amônia para formar 3,5-diacetil-1,4-dihidrolutidina (reação de Hantzch). Este último método pode ser quantificado colorimétrica ou fluorimetricamente e também é a reação mais comumente usada. O CDC utiliza um versão modificada da reação com o ácido cromotrópico como um método de referência para a dosagem dos triglicérides.
Métodos Enzimáticos
Os primeiros métodos eram somente parcialmente enzimáticos, com uma extração em solvente orgânico e hidrólise dos triglicérides com saponificação alcalina. Em seguida usava-se uma série de reações enzimáticas com a utilização de fotometria em ultravioleta. Um avanço significativo foi conseguido com a utilização de uma lipase para promover a hidrólise enzimática dos triglicérides. Existem numerosos métodos comerciais que utilizam reações totalmente enzimáticas para a dosagem dos triglicérides, usando glicerol quinase e glicerol fosfato desidrogenase ou glicerol fosfato oxidase. O método com glicerol fosfato desidrogenase utiliza a glicerol quinase para produzir um derivado fosforilado, que por ação da desidrogenase, na presença de NAD, forma dihidroxiacetona fosfato e NADH, que é medido fotometricamente em 340 nm. Este método tem grande sensibilidade em valores baixos dos triglicérides. Existem produtos que utilizam um acoplamento da reação final com INT e diaforase para produzir um formazan vermelho, que é medido colorimetricamente. O método utilizando glicerol fosfato oxidase se baseia na habilidade da enzima em oxidar o glicerol fosforilado pela glicerol quinase e, na presença de oxigênio, produz dihidroxiacetona fosfato e peróxido de hidrogênio, que é utilizado na reação de peroxidase catalisada pela peroxidase, formando um comóforo, que é medido fotometricamente.
Os métodos totalmente enzimáticos são facilmente automatizáveis, utilizando amostras de soro ou plasma sem qualquer processo de extração prévia. As amostras de plasma ou soro comumente contêm pequenas quantidades de glicerol livre, que pode aumentar falsamente os valores dos triglicérides. Quando se deseja obter resultados exatos ou no estabelecimento de materiais de referência ou materiais calibradores com rastreabilidade a um método de referência, deve-se realizar um ensaio com branco de glicerol, que mede a quantidade de glicerol livre, utilizando os mesmos reagentes, com exceção da lipase. A diferença entre os dois ensaios representa a concentração exata dos triglicérides. A utilização do branco de glicerol não deve ser realizada de rotina em pacientes de ambulatório, a menos que seja economicamente factível. Quando ocorrer a necessidade da dosagem dos triglicérides em pacientes hospitalizados, deve-se utilizar o branco de glicerol porque nestes pacientes existe grande probabilidade de se encontrar valores elevados de glicerol livre.
Também um método definitivo, denominado Diluição Isotópica, foi estabelecido para a dosagem dos triglicérides e utiliza a cromatografia de gás em associação com a
espectrometria de massa. O NIST utiliza este método de ensaio para determinar valores assinalados para materiais de referência.
Padronização e Requerimentos de Desempenho
Uma grande variedade de modelos está disponível para a calibração da determinação dos triglicérides. Os métodos químicos podem ser calibrados com padrões puros de triglicérides dissolvidos em solventes orgânicos. Os métodos enzimáticos não podem usar padrões em solventes orgânicos, porque existe incompatibilidade entre os solventes e as enzimas, podendo ocorrer diminuição ou ausência da atividade das enzimas. Muitos padrões são baseados em glicerol dissolvido em água, mas estes padrões têm uma limitação porque o sistema de calibração não funciona para todo o processo analítico e não avalia o desempenho da lipase. Existem padrões aquosos de triglicérides, onde a substância padrão está emulsionada em um detergente não iônico.
O NIST tem disponível o primeiro material de referência para triglicérides, o SRM 1595, constituindo-se de um padrão de tripalmitina. O 2o material de referência está disponível no CDC na forma de soros congelados. As bases correntes para a exatidão e a precisão dos métodos de ensaio dos triglicérides estão estabelecidas tendo como referência o método do CDC. As metas de desempenho para as medidas dos triglicérides estão definidas em termos do Erro Analítico Total, que toma em conta a inexatidão (bias) e a imprecisão como é mostrado na tabela 4.
Como para o colesterol, a grande vantagem da utilização deste modelo é que uma inexatidão mais significativa pode ser tolerada quando o procedimento é muito preciso. Por outro lado, as imprecisões mais importantes podem ser aceitas se os ensaios são mais exatos. A compreensão das vantagens do emprego do erro total podem ser melhor compreendidas com o exemplo mostrado no apêndice A. Os dirigentes dos laboratórios devem procurar utilizar procedimentos que permitam obter as metas de desempenho mostradas na tabela IV. Devido à marcante variação intra individual dos triglicérides e a controvérsia sobre a exata significação clínica das elevações médias dos triglicérides, metas estritas de exatidão e precisão não são cruciais para as medidas dos triglicérides, quando a finalidade é estabelecer valores médios dos triglicérides nos indivíduos. As recomendações são mais importantes quando se utiliza os valores dos triglicérides na estimativa dos valores do colesterol LDL, empregando a equação de Friedewald.
Interpretação dos Resultados
Os valores dos triglicérides podem ser relatados no sistema convencional (mg/dl) ou no sistema internacional de unidades (mmol/l). Para converter concentrações obtidas em unidades convencionais para unidades SI, multiplicar o valor em mg/dl por 0,0113. Assim, um resultado de 200 mg/dl é igual a 2,26 mmol/l. Em 1994 o NCEP, com o "Adult Treatment Panel" (ATP II), modificou as definições da hipertrigliceridemia, que estão propostas na tabela 5.
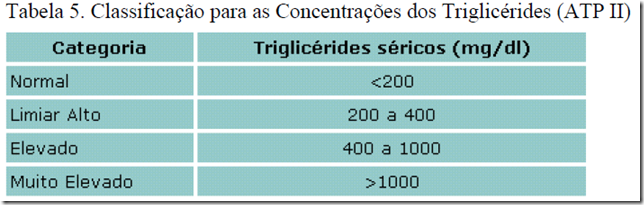
Esta classificação está dirigida às necessidades da avaliação de tratamento dos pacientes hipertrigliceridêmicos e não será discutida aqui por não estar nos propósitos deste trabalho.
O 2º Consenso Brasileiro sobre Dislipidemias considera que os valores desejáveis são menores que 200 mg/dl e que valores maiores que 200 mg/dl estão aumentados e podem atuar como fator de risco juntamente com HDL-C diminuído ou LDL-C aumentado.
PARTE V:
Fosfolípides
Os fosfolípides (fosfoglicérides) têm similaridades estruturais com os triglicérides porque ambos contêm glicerol e ácidos graxos. Entretanto, os fosfolípides contêm um grupamento fosfato ligado a uma a -hidroxila. A esterificação de álcoois como a colina, etanolamina, inositol e serina através do grupo fosfato produz os ácidos fosfatídicos, formando a família dos fosfolípides. Como a molécula do álcool possui um grupamento carregado, os fosfolípides comportam-se como agentes de superfície porque contêm características hidrofílicas e hidrofóbicas, proporcionando uma interface ideal entre os lípides neutros e a água. Os fosfolípides estão entre os principais componentes das membranas celulares .Os fosfolípides do sangue são medidos ocasionalmente no laboratório clínico e especificamente a relação lecitina/esfingomielina, relação L/E, é medida no líquido amniótico e utilizada para avaliação da maturidade pulmonar fetal. Medidas dos fosfolípides são também utilizadas para fornecer uma análise completa da estrutura básica individual da lipoproteina.
A determinação dos fosfolípides é realizada com várias modificações de dois processos básicos. Os procedimentos enzimáticos envolvem a hidrólise dos fosfolípides contendo colina (91 a 97% do total), utilizando a fosfolipase D, a ácido fosfatítico e colina. Em seguida, a colina oxidase é utilizada para oxidar a colina, formando ácido betaínico e H202, e o último é utilizado na clássica reação da peroxidase de Trinder. Os métodos mais antigos para medida dos fosfolípides requerem a separação do fósforo orgânico, seguida da digestão do material orgânico e subsequente determinação do fósforo, utilizando um método para fósforo inorgânico. Estes métodos medem o fósforo fosfolipídico total, não avaliando isoladamente o fósforo presente na fração colina.
Ácidos Graxos Livres
Os ácidos graxos não esterificados (livres) são um constituinte lipídico com pequena concentração no plasma circulante. A maioria dos ácidos graxos livres (FFA), circula no plasma ligada a albumina. Os FFA de ocorrência natural contêm de 14 a 24 átomos de carbono (incluindo o carbono carboxílico) e somente os ácidos graxos contendo números pares de carbono são produzidos em humanos.
Os ácidos graxos são também caracterizados por seu grau de insaturação. Os ácidos graxos saturados não contêm dupla ligação em sua molécula e são o principal tipo ácido graxo do tecido animal. Os ácidos monoinsaturados contêm uma dupla ligação, enquanto os polinsaturados contêm 2 ou mais dupla ligações. Os vegetais, peixes e bactérias são excelentes fontes de ácidos mono e polinsaturados, que são chamados essenciais para humanos, que não são capazes de sintetizar determinados ácidos, como o ácido linoleico é um ácido graxo essencial e deve fazer parte da dieta dos seres humanos.
A função fisiológica primária dos ácidos graxos de cadeia longa é proporcionar energia para as células através de um processo oxidativo denominado oxidação-b, que produz quantidade considerável de energia, mas somente a metade da energia liberada pode ser usada pelas células. A outra metade é liberada na forma de calor. Os ácidos graxos essenciais são precursores necessários para prostaglandinas, que atuam como mediadores metabólicos e desempenham uma função vital na regulação de uma grande variedade de funções fisiológicas.
A determinação dos ácidos graxos livres no soro ou plasma é raramente realizada na Medicina Laboratorial e suas concentrações em indivíduos sadios varia entre 0,30 a 1,10 mmol/l. Entretanto, ocorrem quantidades elevadas quando os ácidos graxos livres são liberados do tecido em distúrbios com excesso de hormônios, especialmente ACTH e epinefrina. Ocorrem também aumentos nos indivíduos submetidos a jejum prolongado ou recebendo heparinoterapia intravenosa.
Os métodos tradicionais para determinação dos ácidos graxos livres envolvem titulação do ácido livre total ou medida da quantidade de cobre complexada pelo ácido. Os dois métodos requerem uma extração orgânica tanto do ácido livre como complexado com o cobre. Mais recentemente dois métodos enzimáticos foram introduzidos e ambos envolvem a formação do complexo acido graxo-coenzima A, por ação catalisadora da acetil coenzima A sintetase, a partir de ácidos graxos livres, ATP e coenzima A.
Um dos métodos utiliza uma combinação de ATP, mioquinase, fosfoenol piruvato, LDH e NADH, com medida da velocidade de oxidação do NADH. O segundo método utiliza a oxidação do complexo acido graxo-coenzima A com a acil-Co-A oxidase, ocorrendo a formação de peróxido de hidrogênio, que é medido através da reação de Trinder.
AS LIPOPROTEINAS
PARTE I:
Os componentes lipídios devem ser capazes de se movimentar entre as células e tecidos para desempenhar suas funções. Como os lípides são insolúveis no meio aquoso plasmático, deve haver um sistema que propicie o transporte dos lípides no organismo. Este sistema consiste na formação das estruturas denominadas lipoproteínas, que são compostos de lípides e proteínas, proporcionando a solubilidade desejada em meio aquoso. As lipoproteínas são complexos macromoleculares de conformação esférica com os ésteres do colesterol e os triglicérides (apolares) colocados na porção central, enquanto o colesterol livre, os fosfolípides e as proteínas, os mais polares, estão dispostos na porção periférica.
Proteínas específicas constituem o componente protéico específico da lipoproteína e são denominadas apoproteínas (apo). Estas contêm domínios hidrofílicos e hidrofóbicos específicos, de modo que parte da lipoproteína está compartilhada adequadamente com o ambiente aquoso, enquanto outra parte da proteína interage com o material lipídico neutro no miolo da lipoproteína. A nomenclatura das lipoproteínas varia com a metodologia utilizada para isolá-las. Assim a eletroforese separa as famílias individuais das lipoproteínas de acordo com sua mobilidade eletroforética em relação às proteínas séricas. Os quilomicrons, devido seu reduzido conteúdo protéico, não têm migração eletroforética, enquanto as outras lipoproteínas migram nas posições alfa e beta. As lipoproteínas ricas em triglicérides apresentam migrações variáveis em função do suporte utilizado.
A ultracentrifugação separa as lipoproteínas com base em suas densidades e utiliza a densidade relativa de cada lipoproteína para sua classificação. A tabela 6 compara os dois sistemas de nomenclatura.

As famílias das lipoproteínas são designadas por suas iniciais derivadas dos critérios da classificação por ultracentrifugação - HDL, LDL e VLDL. Os quilomicrons são a exceção porque têm densidade muito baixa, menor que a densidade do soro. A classificação é ainda mais complicada porque cada família de lipoproteína é representada por uma mistura de complexos lipoprotéicos. A HDL pode ser subdividida nas frações HDL-2 e HDL-3. A densidade da lipoproteína está relacionada com seu conteúdo de proteínas e de triglicérides, com as de menores densidades associadas com elevado conteúdo de triglicérides e baixo teor de proteínas.
O tamanho também é uma característica útil que possibilita distinguir as classes das lipoproteínas. As lipoproteínas ricas em triglicérides (quilomicrons e VLDL) são as maiores partículas com diâmetros aproximados variando de 80 a 1000 nm e 30 a 80 nm respectivamente. As LDL e HDL são particulas muito menores e seus diâmetros variam de 20 a 25 nm e 5 a 10 nm respectivamente. As diferenças de tamanho são mostradas esquematicamente na figura 1.
PARTE II:
Metabolismo das Lipoproteínas
O metabolismo das lipoproteínas pode ser dividido em duas partes separadas, mas que estão interrelacionadas. A primeira parte, denominada metabolismo exógeno, se relaciona com os lípides derivados da dieta. A segunda parte se relaciona com o metabolismo endógeno, que envolve os lípides e lipoproteínas provenientes do fígado e de outras fontes externas (Figura 2).

Figura 2. Lipoproteínas - Sistema Metabólico Exógeno e Endógeno centralizado no Fígado
Metabolismo Exógeno
Aproximadamente 40% das calorias da nossa dieta se originam das gorduras da dieta. Os restantes 60% são provenientes dos carboidratos e das proteínas. Quando os alimentos chegam ao intestino delgado, as enzimas digestivas (amilase, peptidase e lipases) são liberadas. Estas enzimas digerem as moléculas complexas em seus metabólitos, que são absorvidos mais facilmente que seus precursores. Os triglicérides são hidrolisados pelas lipases a ácidos graxos e monoglicérides que, juntamente com o colesterol, são rapidamente absorvidos pela mucosa intestinal. No retículo endoplasmático das células da mucosa entérica ocorre a esterificação do glicerol e do colesterol para formar os triglicérides e os ésteres do colesterol. Estes são reunidos juntamente com a apoproteína B intestinal (B-48), várias lipoproteínas e os lípides polares (fosfolípides e colesterol livre), e os lípides polares formam uma película monomolecular que envolve os lípides não polares no núcleo central da partícula recém-formada, denominada quilomicron. A absorção das gorduras da dieta ocorre rapidamente e um pico dos triglicérides pode ser observado no plasma após 30 a 90 minutos.
Os quilomicrons entram nos vasos lácteos das vilosidades intestinais e são transportados através do canal torácico para o sangue. Na linfa e no sangue os quilomicrons recebem apolipoproteínas adicionais (apo E e apo C) provenientes das HDL. Estes quilomicrons modificados interagem com a lipase da lipoproteína, uma enzima ligada à superfície do endotélio vascular. A lipase da lipoproteína hidrolisa rapidamente os triglicérides a ácidos graxos e glicerol, que são absorvidos pelas células às quais a enzima está ligada. Dentro da célula, os produtos hidrolisados são resintetisados a triglicérides para constituírem fontes de energia. A repetida ação lipolítica da lipase reduz o conteúdo de triglicérides dos quilomicrons, formando os resíduos que são reconhecidos por um receptor na superfície das células do parênquima hepático. A partícula residual fixada é rapidamente captada pela célula (endocitose) e transportada para a região dos canalículos biliares. Ocorre aí o catabolismo lisossômico dos componentes lipídicos e protéicos, incluindo o colesterol esterificado que é hidrolisado a colesterol livre, que pode ser excretado na bile (in natura ou após oxidação para ácidos graxos) ou ser incorporado nas lipoproteínas secretadas pelo fígado. Por causa deste eficiente sistema de transporte, o colesterol absorvido, cerca de 100 a 500 mg/dia, permanece no plasma durante poucos minutos. Portanto, os níveis do colesterol sérico não são afetados, imediatamente, por uma refeição rica em colesterol
PARTE III:
Metabolismo Endógeno
O fígado é o principal órgão do metabolismo lipídico e o local primário da síntese de lipoproteínas de origem endógena. Os triglicérides são sintetizados continuamente no fígado a partir dos ácidos graxos e precursores não lipídicos, em quantidades que variam de 40 a mais de 100 gramas por dia. Como a quantidade de ácidos graxos manipulada pelo fígado excede suas necessidades energéticas, uma fração dos triglicérides deve ser excretada para evitar a esteatose hepática. Esta excreção é realizada através das lipoproteínas de muito baixa densidade, as VLDL. A síntese e secreção das VLDL ocorrem por processos análogos aos da formação dos quilomicrons, mas a apoproteína B (B-100) é necessária para a produção e secreção da VLDL nascente, que também contém as apoproteínas C e E. Após a incorporação das apoproteínas C provenientes da HDL, as VLDL se interagem com a lipase da lipoproteína, do mesmo modo que acontece com os quilomicrons. Ocorre a hidrólise dos triglicérides e a lipoproteína, após a perda dos triglicérides, forma a lipoproteína de densidade intermediária (IDL). Estes resíduos da VLDL não sofrem endocitose e são modificados formando as lipoproteínas de baixa densidade (LDL). Estas modificações geram a perda da maior parte dos triglicérides residuais e dos componentes protéicos, exceto a apoproteína B-100.
As VLDL são metabolizadas em poucas horas, enquanto o metabolismo das LDL ocorre lentamente durante dias, em parte devido à interação com os receptores de alta afinidade para LDL, existentes no fígado e em tecidos extra hepáticos. Após a ligação da LDL com o receptor na superfície celular, a membrana da célula se invagina interiorizando a lipoproteína, formando uma vesícula endocítica. Este processo é denominado endocitose mediada pelo receptor. A vesícula endocítica entrega seu conteúdo aos lisossomas, que são sacos intracelulares unidos à membrana, contendo enzimas hidrolíticas. O componente protéico é hidrolisado a aminoácidos e o colesterol esterificado é hidrolisado a colesterol livre por ação de uma lipase ácida. O colesterol livre passa para o compartimento celular, sendo utilizado para a síntese das membranas. A presença do colesterol na célula também regula 3 eventos metabólicos distintos. Em primeiro lugar ele suprime a atividade de 3- hidroxi-3-metilglutaril coenzima A redutase (HMG CoA redutase), enzima que controla a síntese do colesterol. Em segundo lugar, o colesterol estimula a ação da colesterol acil
transferase, que esterifica o colesterol livre recém-formado. O colesterol esterificado é armazenado na célula na forma de gotículas lipídicas citoplasmáticas. Este colesterol recém formado inibe a síntese dos receptores de LDL, interrompendo a fixação da LDL, evitando assim que as células fiquem sobrecarregadas de colesterol.
A HDL e o transporte reverso do colesterol
As HDL não são secretadas sob uma forma quase final. O fígado e o intestino delgado sintetizam a HDL por um processo análogo à síntese dos quilomicrons e VLDL. Durante a síntese os fosfolípides e colesterol livre são combinados com apoproteínas específicas para formar estruturas discoidais, que passam por extensivas modificações em sua composição e estrutura após a secreção da partícula. A modificação mais importante é a esterificação do colesterol por uma reação enzimática catalisada pela lecitina colesterol acil transferase (LCAT) e constitui a maior fonte de colesterol esterificado no plasma dos seres humanos.
Os ésteres do colesterol formados pela reação promovida pela LCAT promovem a expansão da HDL, que muda sua estrutura discoidal para a forma esférica. Os ésteres de colesterol assim formados podem ser transferidos para a VLDL durante o catabolismo.
O perfil da HDL nascente é modificado concomitantemente às mudanças do conteúdo lipídico. A apoproteína E constitui-se no maior componente de HDL nascente, enquanto a HDL plasmática é caracterizada pela predominância da Apo A, com menores proporções de Apo C e Apo E. A Apo A-I é um ativador da LCAT e sua incorporação deve facilitar todas as reações catalisadas pela enzima. Adicionalmente, a HDL participa na regulação do catabolismo dos triglicérides e na formação dos ésteres do colesterol, fornecendo os cofatores necessários, Apo C-II para ativação e Apo C-III para inibição da atividade da lipase da lipoproteína. A HDL normal pode ainda balancear o transporte da LDL por mediação da remoção do colesterol da célula para os locais de degradação e excreção. Este papel da HDL no transporte reverso do colesterol pode constituir a base da proteção atribuída a esta lipoproteína como um forte e independente fator de risco inverso para doença arterial coronariana, pois acredita-se que um dos fatores responsáveis pelo efluxo do colesterol da célula para o sangue seja a disponibilidade da HDL, que transporta o colesterol das lipoproteínas e das células para o fígado onde os ésteres do colesterol são hidrolisados e excretados na bile. Portanto, esta via de transporte ajuda a evitar o acúmulo do colesterol nas células.
Variação pré-analítica - Colesterol HDL
As concentrações do colesterol HDL medidas em um mesmo indivíduo e em diferentes ocasiões podem flutuar consideravelmente devido às variações biológicas e também às variações do método analítico. As concentrações no sangue são fortemente influenciadas por fatores tais como dieta recente, ingestão de álcool, variações do peso corporal, atividades físicas e hábito de fumar. Os hormônios e outras medicações também produzem variações na concentração do colesterol HDL.
Considera-se que a variação biológica está em torno de 7,5%. Assim em uma série de repetições da dosagem em um mesmo indivíduo, dois terços dos resultados estarão entre ± 7,5% do valor médio. Portanto, a variação biológica se constitui no fator mais importante da variabilidade total do colesterol HDL. Os efeitos da variação biológica podem ser controlados até certo ponto através da padronização das condições de preparo do paciente e da colheita da amostra, mas o colesterol HDL não pode ser estimado com confiança através de um ensaio de uma única amostra. Várias amostras devem ser obtidas e a média dos resultados pode ser considerada como a concentração usual do colesterol HDL ou, mais exatamente, pode ser considerada a faixa usual de resultados para o indivíduo.
Variação pré-analítica - Colesterol LDL
As variações na concentração do colesterol LDL em um mesmo indivíduo resultam da flutuação fisiológica normal que ocorre no dia a dia e também do erro analítico inerente ao processo de medida. Variações fisiológicas normais ocorrem independentemente do erro analítico, mesmo em condições ideais nas quais o erro analítico é próximo de zero. Esta variação biológica é observada quando a dosagem é repetida em um mesmo indivíduo e realizada sob as mesmas condições analíticas. Os dados disponíveis sugerem que a variação biológica do colesterol LDL oscila entre 6 e 11%, com um valor médio de 8,2%.
Como a VLDL é uma lipoproteina caracteristicamente transportadora dos triglicérides, considera-se que a variação do colesterol VLDL ocorre em paralelo com as variações dos triglicérides (ver variação pré analítica dos triglicérides).
Considerações sobre a amostra
Os cuidados a serem tomados com as amostras para as dosagens do colesterol ligado às HDL e LDL devem ser os mesmos aplicados para as dosagens do colesterol. Deve-se entretanto ressaltar que as amostras devem ser obtidas após jejum de 12 horas para evitar a presença de quilomicrons, que além de produzirem interferências nos processos de precipitação, aumentam os valores dos triglicérides, com conseqüente aumento do colesterol VLDL, gerando valores incorretamente diminuídos do colesterol LDL. Não se deve utilizar plasma com EDTA para as dosagens do colesterol HDL quando se usa um reagente precipitante contendo magnésio, porque a quelação deste íon pode modificar o desempenho do reagente.
PARTE IV:
Metodologias de Ensaio
Numerosos estudos epidemiológicos têm demonstrado a associação do aumento do risco de desenvolvimento da doença arterial coronariana com a elevação na concentração do colesterol plasmático. Devido a essa importante associação, juntamente com a observação de que os valores do colesterol ligado às lipoproteínas de alta densidade constituem um fator de risco inverso, enquanto os valores do colesterol ligado às LDL representam um fator de risco direto para o aparecimento da doença arterial coronariana, o procedimento mais comum nos laboratórios clínicos constitui-se na avaliação do colesterol ligado a estas duas lipoproteínas. Alia-se também as facilidades encontradas para o desenvolvimento de metodologias destinadas à medida do colesterol ligado às mesmas lipoproteínas.
Determinação do Colesterol HDL
Nos últimos 10 a 15 anos, a medida do colesterol HDL (HDL-C) tem se tornado uma conduta rotineira nos laboratórios clínicos, como parte do perfil utilizado para estabelecer o risco individual da doença arterial coronariana (DAC), A HDL é a menor lipoproteina em tamanho, inclui uma família complexa de partículas lipoprotéicas que ocorre em estado constante de fluxo dinâmico à medida que elas se interagem com outras partículas HDL e com as partículas LDL e VLDL. A HDL tem a mais elevada proporção de proteínas em relação ao conteúdo lipídico, contendo mais de 50% de proteínas. As apoproteínas AI e AII constituem os maiores componentes protéicos, com pequenas quantidades de Apo C, E, AIV e D. Os fosfolípides constituem o principal componente lipídico, com colesterol esterificado, colesterol livre e triglicérides presentes em menores concentrações (tabela 7).
Como o colesterol esterificado é hidrolisado na maioria dos ensaios para colesterol, a parcela esterificada é dosada como colesterol livre.

O HDL-C se refere à fração do colesterol total (livre e esterificado) ligado à partícula HDL, como definido na ultracentrifugação, ainda que na prática comum as frações separadas por precipitação química ou eletroforese são também denominadas como HDL. Portanto, a HDL é definida pelo processo utilizado para seu isolamento e inclui uma família de partículas similares que variam em tamanho, química e composição.
Ultracentrifugação
As lipoproteínas podem ser separadas com base em suas diferentes densidades usando as técnicas de ultracentrifugação. A proporção dos lípides, especialmente os triglicérides, associada com as proteínas em uma lipoproteína em particular, confere as características de flutuação de um complexo lipoprotéico, permitindo a separação das maiores classes de lipoproteínas. O fracionamento das lipoproteínas pode ser conseguido na ultracentrifugação após a correção da densidade da amostra com sais de brometo de sódio ou de potássio.
Método de Referência do CDC
O método utiliza três etapas básicas:
1. Ultracentrifugação na densidade 1,006 kg/l para isolar a HDL e a LDL dos quilomicrons e da VLDL. Este procedimento elimina as lipoproteínas ricas em triglicérides, que podem produzir interferências na precipitação seletiva da LDL na etapa 2.
2. Precipitação seletiva da LDL com heparina/MnCl2.
3. Dosagem do colesterol no sobrenadante com o método de referência do CDC (Abell- Kendall), utilizando um volume maior do sobrenadante para aumentar a sensibilidade na faixa de valores baixos do HDL-C. Ainda que não exista um método de referência validado para o HDL-C, o do CDC pode ser considerado como o melhor corrente para transferir exatidão a outros métodos de ensaio, através do suprimento de materiais de referência ensaiados por esse método. Portanto, o método do CDC é recomendado como referência para calibração e verificação da exatidão dos métodos de rotina.
Evidentemente, esse procedimento não tem aplicação na rotina dos laboratórios clínicos, ficando reservado para a preparação de materiais de referência, porque depende de equipamento de alto custo e de pessoal com elevado nível de treinamento nas técnicas de ultracentrifugação e na separação da fração contendo as lipoproteínas ricas em triglicérides.
Precipitação seletiva
A precipitação química seletiva foi introduzida em 1960 por Burstein e Samaille como um método rápido para medida do colesterol ligado às lipoproteínas. Esta precipitação pode ser obtida pela mistura de poliânions e cátions divalentes ou outras substâncias químicas com amostras de soro ou plasma, conforme mostrado na tabela 8. Várias propostas de modificação ou variação têm sido relatadas para cada método de precipitação química, visando aperfeiçoar a seletividade ou desempenho do sistema de separação.

A seleção do reagente mais adequado para um determinado laboratório não é uma decisão simples. Deve-se empreender um esforço para realizar uma avaliação profunda de cada método para estabelecer todas as características de desempenho e otimizar o procedimento para se assegurar que o colesterol presente no sobrenadante representa com exatidão o HDL-C da amostra. Existem várias razões para a difusão e aceitação das técnicas de precipitação pelos laboratórios clínicos e as principais são:
• Interesse aumentado na quantificação de rotina do HDL-C.
• Não requer equipamento de alto custo como uma ultracentrífuga.
• Dosagem do colesterol diretamente no sobrenadante.
• Pode ser parcialmente automatizado em grandes rotinas.
Portanto, o HDL-C é facilmente dosado por um método simples e de baixo custo, quando comparado com a ultracentrifugação ou a eletroforese.
Correntemente, a maioria dos laboratórios clínicos utiliza os procedimentos com fosfotungstato-magnésio ou o dextran sulfato. No Lepac da Control-Lab em 1996, o maior número dos participantes utilizou a precipitação com ácido fosfotúngstico. No programa de proficiência do Colégio de Patologistas Americanos, a maioria dos respondentes em 1996, utilizou os métodos com fosfotungstato-magnésio ou com dextran sulfato, em uma proporção de 50% para cada método.
As técnicas de precipitação proporcionam resultados reprodutíveis quando utilizadas em conjunto com métodos sensíveis e reprodutíveis para a dosagem do colesterol. Entretanto, uma abordagem confiável para assegurar exatidão nos ensaios de rotina do HDL-C é a comparação dos resultados com o método do CDC ou método equivalente com exatidão definida.
O manual de métodos para medida dos lípides e lipoproteínas, editado pela AACC, propõe o seguinte conjunto de medidas para ajudar os laboratórios na verificação de seus procedimentos para a dosagem do HDL-C.
1. Otimizar o método para dosagem do colesterol.
a. Linearidade de 0-120 mg/dl.
b. Reprodutibilidade com 1 desvio padrão igual a 2 mg/dl ou menos.
c. Comparar os resultados dos pacientes com outro laboratório.
2. Selecionar um laboratório usando um método similar.
a. O bias do colesterol entre os 2 laboratórios deve ser mínimo.
b. Analisar as amostras submetidas às mesmas condições com relação ao tempo e condições de armazenamento para minimizar as difereenças de resultados por deterioração da amostra. Fazer uma correlação dos resultados aplicando a regressão linear. A inclinação (b) deve estar entre 1,0 ± 0,3 e o ponto de intersecção (a) deve ser menor que 5,0 mg/dl.
3. Utilizar material volumétrico com precisão e exatidão adequadas.
Quando utilizar automação para a colorimetria, manter o instrumento em condições adequadas de operação e manutenção. Verificar periodicamente a calibração de acordo com as instruções do fabricante.
4. Estabelecer condições específicas para processamento da amostra:
a. Controle do tempo de mistura amostra-precipitante.
b. Tempo e temperatura de incubação quando necessário.
c. Tempo, temperatura e força centrífuga (g) na centrifugação.
Existem alguns experimentos que podem ser realizados para assegurar as características de separação de um dado procedimento. Os seguintes processos podem ser usados em uma série de amostras para avaliar a especificidade de um método para HDL-C.
1. A eletroforese do sobrenadante e do precipitado tornado solúvel proporcionam uma indicação da separação. O precipitado deve ser lavado com solução salina/precipitante (1:1) e dissolvido em NaCl 0,6mol/l. Na eletroforese o sobrenadante deve conter somente a banda alfa, sem o aparecimento das bandas beta e pré-beta, enquanto o precipitado não deve mostrar a banda alfa.
2. Selecionar várias amostras com concentrações variáveis de triglicérides para comparar o desempenho do ensaio para HDL-C em concentrações diferentes de triglicérides. Alguns métodos proporcionam separações adequadas somente para valores menores que 400-450 mg/dl. As amostras com quilomicrons podem produzir valores erráticos, com sobrenadantes turvos e valores incorretamente elevados do HDL-C. Estas amostras devem ser reprecipitadas ou os sobrenadantes filtrados para obter resultados confiáveis.
Dosagem Direta Homogênea
Muito recentemente surgiram 2 métodos para dosagem direta homogênea do colesterol HDL, que não requerem a preparação da amostra, permitindo, inclusive, ensaios totalmente automáticos usando tubos primários. Um dos métodos utiliza, em uma primeira etapa, formação seletiva de complexos das LDL, quilomicrons e VLDL com a ciclodextrinas e sulfato de dextran, em um pH ligeiramente alcalino, contendo cloreto de magnésio. Na segunda etapa é introduzida uma reação com enzimas modificadas pelo polietileno glicol, as quais não atuam sobre os complexos lipoprotéicos acima. As enzimas modificadas reagem somente com o colesterol HDL, permitindo sua medida colorimétrica através de uma reação modificada de Trinder.
Todo o procedimento é realizado diretamente em sistemas manuais ou automáticos. As interferências descritas são bilirrubina maior que 18 mg/dl, fator reumatóide maior que 1000 UI/ml, hemoglobina maior que 1000 mg/dl e triglicérides maiores que 600 mg/dl.
O procedimento sofre ainda interferência dos métodos para triglicérides, usando glicerol fosfato oxidase e a reação de Trinder e requer um procedimento especial de lavagem dos sistemas automáticos.
Este método está ajustado para fornecer resultados similares ao que usa precipitação seletiva com fosfotungstato-magnésio e tem boa correlação com o ensaio utilizando dextran sulfato-manganês. O procedimento não foi comparado com um método de referência, seja do CDC ou similar. A precisão do ensaio é adequada, tanto para valores baixos como elevados.
O outro método utiliza dois reagentes, que possibilitam a dosagem seletiva do colesterol ligado às HDL. O primeiro reagente contém um poliânion que forma complexos com a superfície das LDL, VLDL e dos Quilomícrons. Estas lipoproteínas revestidas pelos complexos permanecem estabilizadas mesmo na presença de um detergente que faz parte do segundo reagente. Esta estabilização inibe totalmente a ação das enzimas sobre o colesterol presente nessas lipoproteínas. Por outro lado, os complexos formados com as partículas da HDL não permanecem estabilizados e se solubilizam por ação do detergente, permitindo a ação das enzimas do reagente para colesterol presentes no segundo reagente.
Como somente o colesterol HDL fica sujeito à ação das enzimas, a cor resultante da segunda reação é diretamente proporcional à concentração do colesterol HDL na amostra.
Os reagentes são líquido-estáveis e o processo é totalmente automatizável.
Valores de Bilirrubina até 30 mg/dl, Hemoglobina até 400 mg/dl, Ácido Ascórbico até 50 mg/dl e Triglicérides até 1463 mg/dl não interferem na reação. Amostras contendo valores dos interferentes maiores que os acima referidos, devem ser diluídas em NaCl 150 mmol/l (0,85%) antes de realizar os ensaios.
Os dois métodos foram recentemente colocados à disponibilidade da comunidade científica e ainda não foram exaustivamente avaliados, principalmente no que se refere à exatidão dos resultados.
PARTE V:
Padronização e Requerimentos de Desempenho
Alguns fatos têm sido observados com relação aos resultados do colesterol HDL. Os levantamentos de proficiência têm sugerido que o desempenho dos laboratórios não é adequado e os dados obtidos indicam que a exatidão é um requerimento essencial porque o colesterol HDL é um fator de risco inverso para a DAC e também porque sua exatidão introduz erros nos cálculos do colesterol LDL. Como para o colesterol e triglicérides, o programa Nacional de Educação em Colesterol dos Estados Unidos (NCEP) tem procurado promover o aperfeiçoamento dos ensaios para HDL-C nos laboratórios clínicos e estabeleceu as metas de desempenho para todos eles. As metas correntes estabelecem que os métodos devem ter a imprecisão igual ou menor que 6%, com bias iguais ou menores que 10% (tabela 9) e que o desempenho obtido pelo laboratório deve ser documentado. Para o ano de 1998, o NCEP reduziu os limites máximos de desempenho, visando aperfeiçoar os resultados, fazendo com que eles sejam mais confiáveis.

O NCEP recomenda que estes critérios sejam aplicados em todos o processos usados para a dosagem do colesterol HDL e que os laboratórios devem aplicar todos seus esforços para atingir as metas propostas para 1998. Segundo Levy, os laboratórios devem procurar dosar o HDL-C com exatidão, na faixa menor que 50 mg/dl e serem capazes de distinguir uma diferença menor que 5 mg/dl quando o HDL-C for utilizado para definir o risco individual.
Aos fabricantes é recomendado que os resultados obtidos com seus produtos sejam validados com métodos de referência, usando métodos estatísticos apropriados para comparar métodos de ensaio e que os resultados sejam rastreáveis àqueles obtidos por laboratórios de referência.
Determinação do Colesterol LDL
A relação positiva entre a concentração do colesterol total e a DAC é o achado mais consistente nos estudos epidemiológicos realizados nos últimos 15 anos. O colesterol LDL (LDL-C) corresponde a dois terços do colesterol total e se constitui na fração aterogênica primária do colesterol sérico.
A LDL consiste de um núcleo hidrofóbico composto de ésteres do colesterol e triglicérides, revestido de uma cobertura composta de fosfolípides, colesterol livre e apoproteínas. Cada partícula de LDL contém na superfície uma molécula de apoproteína B-100 (apo B-100) e menor quantidade de apo E. Contém, em média, 38% de colesterol esterificado, 22% de fosfolípides, 21% de proteínas, 11% de triglicérides e 8% de colesterol livre.
Determinações exatas do LDL-C dependem da separação das partículas LDL, de outras partículas como as HDL e VLDL e consequente medida do LDL-C. Pode-se utilizar métodos baseados em características físicas como densidade, tamanho, carga ou composição de apoproteínas. Tradicionalmente as LDL têm sido definidas como todas as lipoproteínas com densidades maiores que 1,019 kg/l e menores 1,063 kg/l. Entretanto, na prática corrente esta definição tem sido alargada para incluir a IDL com densidades entre 1,006 e 1,019 kg/l. Vários métodos utilizando ultracentrifugação têm sido propostos para a separação das LDL, mas vamos apresentar de maneira sucinta o método utilizado em vários laboratórios de pesquisa em lipoproteínas nos Estados Unidos.
Quantificação beta
É um método similar ao utilizado com a ultracentrifugação para a separação do HDL-C e foi denominado quantificação beta porque as LDL são também denominadas lipoproteínas de migração beta na terminologia eletroforética. Uma amostra igual a 5 ml de plasma é transferida para um tubo especial para ultracentrifugação, sendo superposta cuidadosamente 1 ml de salina com desnidade 1,006 kg/l (NaCl 150 mmol/l). O tubo é selado e centrifugado por tempo e força centrífuga prédefinidos.
Em seguida o tubo é cortado por um aparelho especial, no limite da densidade 1,006, para separar o sobrenadante contendo as VLDL, que é descartado. A porção contendo as HDL e LDL é transferida quantitativamente e promove-se a precipitação do colesterol HDL, por método já descrito na dosagem do HDL-C. O colesterol do sobrenadante é medido pelo método de Abell-Kendall. Pode-se também utilizar um método enzimático bem padronizado com vistas à redução de custos. Este método é considerado como referência para a determinação do LDL-C e ainda não está disponível um método definitivo.
Precipitação seletiva
Vários métodos para precipitação química seletiva das LDL têm sido reportados. Estes métodos quantificam o LDL-C como a diferença entre o Colesterol Total e as VLDL-C e HDL-C solúveis no sobrenadante. Eles são precisos e produzem resultados razoavelmente exatos, quando comparados com a ultracentrifugação e quando os valores dos triglicérides são baixos. A maioria dos pesquisadores observou que os métodos de precipitação são perturbados pelo aparecimento de erros sistemáticos quando amostras contendo valores elevados de triglicérides são analisadas. Portanto, os métodos para medida do LDL-C por precipitação mostram as mesmas limitações da equação de Friedewald e não demonstram apresentar alguma vantagem para a determinação rotineira do LDL-C. Devido às limitações e por representar o um ensaio adicional, que não acrescenta benefícios para a determinação do LDL-C, é um método pouco utilizado como demonstra o número de respostas dos participantes do programa de proficiência do Colégio Americano de Patologistas (CAP) no ano de 1996, mostradas na tabela 10.
PARTE VI:
Métodos por imuno separação
Nestes métodos, as partículas LDL não são separadas por suas características de densidade, mas através da composição de apoproteínas da LDL e das outras lipoproteínas. Um método comercial empregando esta metodologia está disponível e utiliza partículas de látex ligadas a anticorpos anti Apo A-I e anti Apo E humanas. Após mistura e incubação da amostra de soro com as partículas conjugadas com os anticorpos, aplica-se um processo de separação associado com filtração e centrifugação, ficando as partículas HDL e VLDL e Quilomicrons retidas no filtro, enquanto as LDL passam no filtrado que é usado para a medida do LDL-C. A LDL e a lipoproteína A não contêm as apoproteínas para as quais os anticorpos estão dirigidos e não se ligam às partículas de látex, passando para o filtrado. Ficam retidas também as IDL ou resíduos das VLDL, que são medidos quando se usa a quantificação beta, mas este fato produz pouco impacto na maioria das amostras, permitindo uma boa correlação entre o método de imuno separação e a quantificação beta.
Método recomendado para rotina
O método de cálculo do LDL-C através da equação de Friedewald é o procedimento mais frequentemente usado para calcular o valor do LDL-C (ver tabela YY), mas algumas condições são exigidas para que os resultados sejam confiáveis e possam ser considerados como tendo exatidão adequada. A concentração dos triglicérides deve ser menor que 400 mg/dl.
A amostra não deve conter quilomicrons.
A amostra não deve conter beta-VLDL, característica da hiperlipoproteinemia tipo III.
Quando uma ou mais das condições acima não são cumpridas, o método não pode ser usado e o LDL-C somente poderá ser dosado com exatidão adequada usando a beta quantificação ou o método de imuno separação.
O LDL-C é estimado com a seguinte fórmula:
LDL-C = Colesterol Total - HDL-C -Triglicérides/5, onde Triglicérides/5 é uma estimativa do VLDL-C e todas as concentrações são expressas em mg/dl.
A principal vantagem deste procedimento é sua simplicidade, requerendo somente as medidas do colesterol total, HDL-C e triglicérides. Warnick et al observaram que nas amostras em que os triglicérides são menores que 200 mg/dl, 90% dos valores calculados pela equação de Friedewald estão dentro de ± 10% dos valores encontrados com a quantificação beta. Em valores dos triglicérides entre 200-400 mg/dl e 400-600 mg/dl, somente 72% e 39% dos resultados se encontram entre ± 10% dos resultados obtidos com a beta quantificação. A equação de Friedewald deve ser usada com cautela em indivíduos hospitalizados porque pode-se encontrar valores falsamente elevados dos triglicérides devido à presença do glicerol livre, que pode estar aumentado nos indivíduos recebendo alimentação parenteral, heparina ou em estado grave. É importante salientar que as amostras devem ser obtidas após jejum de 12-14 horas para evitar a presença de quilomicrons e logicamente valores falsamente elevados do VLDL-C.
Padronização e requerimentos de desempenho
O NCEP também tem suas recomendações para as metas de desempenho dos resultados do LDL-C, que são mostrados na tabela 11. Como o LDL-C é um dado muito importante para avaliação do risco de DAC em um indivíduo e é a base das decisões para introduzir um tratamento com dieta ou medicamentos, os laboratórios devem procurar aplicar todos os esforços para conseguir um desempenho igual ou melhor que o proposto pelo NCEP.

Como a grande maioria dos resultados do LDL-C são obtidos a partir de cálculos com as concentrações do colesterol total, colesterol HDL e triglicérides, os resultados do LDL-C, tanto em precisão como exatidão, serão totalmente dependentes dos resultados utilizados para o cálculo. Assim, os esforços dos laboratórios devem ser dirigidos no sentido de manter os níveis de exatidão e precisão dos três itens utilizados nos cálculos, pelo menos, dentro daqueles propostos pelo NCEP.
Interpretação dos resultados A potente associação entre a elevação do LDL-C e a DAC originou um consenso para tratamento dos valores elevados no soro, havendo uma recomendação de que o LDL-C deve ser usado como critério primário para a decisão de tratamento dos pacientes com hipercolesterolemia. Esta recomendação torna imperativo que o colesterol total, LDL-C e o HDL-C sejam determinados com a maior exatidão possível.

Valor do Colesterol LDL (sem história de DAC)
Quando o paciente tem história anterior de DAC, os valores alvo para o desempenho do LDL-C são diferentes e consistem em valores ótimos quando são menores que 100 mg/dl e os valores acima de 100 mg/dl são considerados elevados.
Enfatizamos que todos os dados aqui mostrados demonstram que os laboratórios devem procurar estabelecer programas de qualidade para que os resultados, tanto do LDL-C como de todos os outros lípides utilizados no perfil lipídico moderno, tenham exatidão e precisão as mais adequadas possíveis, para que possam ter utilidade médica e para que selecionem corretamente os pacientes que devem receber tratamento.




Nenhum comentário:
Postar um comentário
► NÃO faça comentários ofensivos
► Faça comentários apenas RELATIVOS ao assunto do artigo
► NÃO faça conversas irrelevantes nos comentários, isso não é um chat
► É PROIBIDO usar links desnecessários, para isso comente usando OpenID
► Os comentários são VERIFICADOS, para garantir que não seja violada as regras acima
Se preferir, fale conosco link de CONTATO.